(1)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,
这主要是由于摄取 (填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②青霉素是医学上最早使用的天然 素,在体内经酸性水解后得到青霉氨基酸其结构简式为: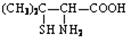 ,请写出青霉氨基酸可能具有的一种化学性质 。
,请写出青霉氨基酸可能具有的一种化学性质 。
③下列可作为食品着色剂的是 A.食盐 B.柠檬黄 C.青霉素
(2)①糖类、油脂、蛋白质都是人体必需的营养物质。油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称)。
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和 (写名称)。人体中共有二十多种氨基酸,其中人体自身 (填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
③淀粉在淀粉酶的作用下最终水解为 (写化学式),部分该产物在体内被氧化放出能量,供人体活动需要。
(3)材料通常可分为金属材料、无机非金属材料、高分子合成材料等。
①三大合成材料是指:塑料、合成纤维和 ;塑料制品造成的环境问题通常称为 。
②橡胶是制造轮胎的重要原料,天然橡胶通过 措施可增大强度和弹性。
③钢铁在潮湿的空气中更容易被腐蚀,主要原因是其中的铁和碳构成许多微小的 ,发生电化学腐蚀。发生电化学腐蚀。钢铁发生电化学腐蚀时,负极的电极反应是 。
(4)①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 。
②常用的污水处理方法有三种,分别是 、中和法和沉淀法。
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。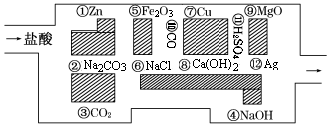
(1)请你帮助它走出迷宫(请用图中物质前的序号表示):____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有个。
(1)下列物质能导电的是(填序号,下同),属于电解质的是,属于非电解质的是。
①水银②CuSO4•5H2O③大理石④氯化钠晶体⑤盐酸⑥氨气
⑦蔗糖⑧氯气⑨液态氯化氢⑩硫酸溶液
(2)按要求回答下列问题。
①Al2(SO4)3的电离方程式:
② NaHCO3的电离方程式:
③用化学方程式说明次氯酸钙粉末必须密封保存的原因:
④写出氯气与水反应的离子方程式:
(3)按要求完成下列填空:
①相同质量的氢气、甲烷、水,其中含分子数最多的是。
②4.9 g H2SO4共含有个原子。
③a个X原子的总质量为b g,则X的相对原子质量可表示为________。
某课外兴趣小组用下图装置进行实验,试回答: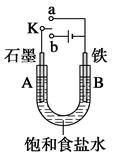
(1)若开始时开关K与a连接,则A电极反应式为_____________________。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做,
则B电极反应式为______________________。开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为。
合成氨反应N2(g)+3H2(g) 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。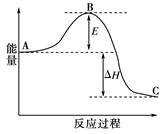
请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?__。理由是_________;
(2)图中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2,经过50 min,NH3的浓度为1mol·L-1,
则v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)=2NH3 (l)的热化学方程式 ________。
按要求填空: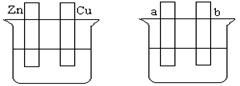
A B
(1)在A图中,稀硫酸为电解质溶液,用导线连接后,铜片电极反应式。
(2)在B图中外接直流电源,若要在a极镀铜,加以必要的连接后,该装置叫,b极电极反应式。
(3)在B图中外接直流电源,若电极为惰性电极,电解质溶液是CuSO4溶液(足量),电解总反应离子方程式为,阴极增重3.2 g,则阳极上放出的气体在标准状况下的体积是_____L,加入一定量的后(填化学式),溶液能恢复至与电解前完全一致。