(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。
a. 2C2H6 —14 e- +7O2 ="== " 4CO2 + 6 H2O
b. C2H6 —14 e- + 18 OH- ="== " 2 CO32- + 12 H2O
c. O2 + 2H2O + 4 e- ="==" 4OH-
d. O2— 4 e- + 4H+ ="==" 2H2O
(3)在下图所示实验装置中,石墨棒上的电极反应式为 ;如果起始 时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。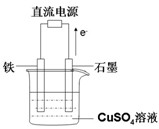
硝酸是一种具有强氧化性、强腐蚀性的无机酸,在储运过程中要严防泄漏。回答下列有关问题:
(1)硝酸储运罐子上应贴有的安全标识是(填序号)__________
① ②
② ③
③ ④
④
(2)一般在运输浓硝酸时采用的储藏罐材料是_____(填序号),原因是_________。
①铁②铝③铜④陶瓷
(3)从硝酸泄漏现场可以看到大量的红棕色气体弥漫,该红棕色气体的成分是。
(4)由于硝酸泄漏后与其他物质发生反应,并放出大量的热,故可在地面铺撒______(填序号),并及时用水降温。
①氯化钙②氯化钠③生石灰④熟石灰
(1)近年来我国京、津、冀等多地出现雾霾天气,主要原因是空气污染严重所致,下列有关治理空气污染的方法正确的是___________。
A.大力开发核能、氢能、风能、海洋能和生物质能等能源
B.限制使用电动车
C.我国煤炭储量丰富,可以大力发展火力发电
D.节日可尽情燃放烟花爆竹
(2)食品中加入营养强化剂是为了补充食品中缺乏的营养成分或微量元素。下列说法中不正确的是____。
A.人体缺碘,可通过食用加碘盐补碘
B.亚硝酸盐可常用作腌制肉类食品的防腐剂,大量进食易致癌
C.维生素或钙、硒等不能添加在食品中
D.缺铁性贫血,可通过食用铁强化酱油预防
(3)下列关于药物使用的说法中,正确的是___________。
A.长期大量服用阿司匹林可预防疾病,没有毒副作用
B.随着平价药房的开设,病人都可以到药店自行买药服用,不用到医院就诊
C.使用青霉素可直接静脉注射,不需要进行皮肤敏感试验
D.碘酒能使蛋白质变性,医院里常用于皮肤消毒
(4)在我国一些大城市,汽车等机动车排出的一些大气污染物主要有CO、、和碳氢化合物等。治理汽车尾气中NO和CO 的一种方法是:在汽车的排气管上装一个催化转化装置,使NO和CO反应,生成CO2和N2,反应的化学方程式是。
(11 分)下表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:
| 族 周期 |
ⅠA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
请按要求回答下列问题:
(1)写出③的元素符号。
(2)7种元素中,原子半径最小的是(填序号)。
(3)元素④的氢化物与元素⑦的单质反应的离子方程式为。
(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为(用化学式表示)。
(5)元素②形成的最简单氢化物的空间结构为。
工业制硅的主要化学反应是:
请回答下列问题:
(1)该反应的反应类型属于(填字母)
| A.复分解反应 | B.化合反应 | C.分解反应 | D.置换反应 |
(2)该反应中SiO2的作用是(填“氧化剂”或“还原剂”)
(3)硅是人类将太阳能转换为的常用材料。
下图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH === 2K2CO3+6H2O
请回答:
(1)甲池是__________(填“原电池”或“电解池”),通入CH3OH的电极作为_____极,通入O2的电极作为_____极,该电极反应式为_________________________________。
(2)乙池是__________(填“原电池”或“电解池”),A电极名称为_____极,电极反应式为_________________________________。
(3)甲池中溶液的pH_____ (填“增大”、“减小”或“不变”);乙池中溶液的pH_____(填“增大”、“减小”或“不变”)。
(4)当乙池中B(Ag)极的质量增加5.40 g时,电路中转移电子的物质的量是_____mol,甲池中理论上消耗O2_____mL(标准状况下)。