氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol,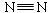 键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下该反应的化学平衡常数K= ;反应达到平衡后,保持温度、容积不变,若向平衡体系中加入0.4 mol N2 、 1 mol H2和0.2 mol NH3 ,化学平衡将
向 方向移动(填“正反应”或“逆反应”)。
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下: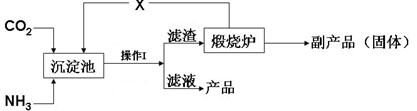
①向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是 。操作Ⅰ的名称是 。
②煅烧炉中产生的固态副产品为 ,生产流程中能被循环利用的物质X为 。
I:已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:T℃时物质的浓度(mol•L-1)变化
| 时间/ min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 ,T℃时该化学反应的平衡常数是 。在该温度下,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和2.0mol H2,则反应向 进行。(填“正反应方向”或“逆反应方向”)。
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol•L-1,则CO在此条件下的转化率为 ,如果保持体积不变向该密闭容器中再充入1 mol氩气,平衡时CO的转化率(填“变大”“不变”“变小”)。
(3)397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“<”、“>”或“=”)。
Ⅱ:工业上可用CO和H2在一定条件下合成甲醇,反应为:
CO(g)+2H2(g) CH3OH(g)ΔH=Q kJ•mol-1
CH3OH(g)ΔH=Q kJ•mol-1
现在容积均为2L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
(1)该反应的Q0(选填“<”、“>”或“=”,下同),K1K2。
(2)300℃时,该反应的平衡常数为。
(3)将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有:____________
(至少答2种) 。
根据下列化合物:①NaOH,②H2SO4,③CH3COOH, ④NaCl, ⑤CH3COONa, ⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4, ⑨NH3•H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=;
在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
| A.向水中加入NaHSO4固体 | B.向水中加NaHCO3固体 |
| C.加热至100℃[其中c(H+)=1×10-6 mol•L-1] | D.向水中加入NH4Cl固体 |
(4)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 mn (填“<”、“>”或“=”)。
(5)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)___ ___。
(6) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH 浓度由大到小的顺序是(填序号)。
浓度由大到小的顺序是(填序号)。
(7)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
短周期元素A、B、C、D原子序数依次增大,且A是短周期元素中原子半径最小的元素。A、C位于同一主族,B的最外层电子数次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)D与C的最高价氧化物对应水化物反应的化学方程式为。
(2)A和C形成的化合物的电子式为;B、C形成的化合物中稳定性较强的物质其阴、阳离子的个数比为。
(3)与B同主族的元素E与D的氢化物稳定性。
在陶瓷工业生产中往往由于陶土里混有氧化铁而使产品质量受到影响。解决的方法是:将陶土和水一起搅拌,使陶土粒子直径达到10-9—10-7 m,然后插入两根电极,接通直流电源,这时正极聚集____________________,负极聚集_______________________,从而除去氧化铁。理由是____________________。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室
里从海藻中提取碘的流程如下图:
(1)指出提取碘的过程中有关的实验操作名称:
①____________;写出过程②中有关反应的离子方程式:
________________________________________________________________________。
(2)灼烧海带用到的硅酸盐仪器有
________________________________________________________________________。
(3)提取碘的过程中,可供选择的有机试剂是( )
| A.酒精 | B.四氯化碳 |
| C.甘油 | D.醋酸 |