洪灾过后,饮用水的杀菌消毒成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(2)实验室常用软锰矿(主要成分为MnO2) 和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)
和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓) MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
(3)检验Cl2已集满的方法: 。
(1)向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH7,(填>、=、<,下同)离子反应总方程式为。
(2)向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的 pH7,离子反应总方程式为 。
。
化合物SOCl2是一种液态化合物,沸点为77℃。在盛10ml水的锥形瓶中小心滴加8-10滴SOCl2可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出,该气体可使湿润的品红试纸褪色。在反应后的溶液中滴加AgNO3溶液,可生成一种不溶于稀HNO3的白色沉淀。
(1)试据上述实验事实,写出SOCl2与水反应的化学方程式。
(2)将ZnCl2溶液蒸发至干,得不到无水ZnCl2,工业上常用ZnCl2•2H2O与SOCl2共热制取ZnCl2。试结合离子方程式解释原因:。
(3)科学家经常利用 水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:。
水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:。
 在一定体积的密闭容器中,进行如下化学反
在一定体积的密闭容器中,进行如下化学反 应:
应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。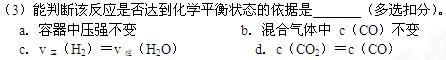
恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) 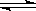 C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的
量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x=mol.
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
mol.
等物质的量A、B、C、D四种物质混合,发生如下反应: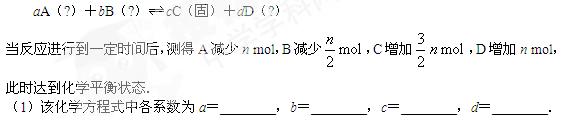
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是
________反应(填“放热”或“吸热”)