工业上冶炼铝时需用到一种熔剂冰晶石(Na3AlF6),工业制冰晶石的化学方程式为:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1)写出工业冶炼铝时阳极电极反应式 。
(2)在上述反应的反应物和生成物中,属于酸性氧化物的化合物的电子式 。
(3)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属强弱的是 (选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(4)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为 。
电解铝厂的实验室为测定铝土矿(主要成分是Al2O3,杂质是Fe2O3 、SiO2)样品中Al2O3的质量分数,操作如下:
Ⅰ.将铝土矿样品粉碎后加入足量稀H2SO4溶液,充分反应后过滤,得滤液a
Ⅱ.向滤液a中加入足量NaOH溶液,充分反应后过滤,得滤液b
Ⅲ.向滤液b中通入足量CO2,充分反应后过滤、洗涤,得Al(OH)3沉淀
Ⅳ.……
(1)滤液a中阳离子有(写离子符号)。
(2)操作Ⅱ中反应的离子方程式是。
(3)操作Ⅳ是。
(4)要测定铝土矿样品中Al2O3的质量分数,所需数据是(质量数据用x、y…表示,单位是g);铝土矿样品中Al2O3质量分数表达式是(用含x、y…的式子表示)。
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g) CH3OH(g) △H="a" kJ/mol
CH3OH(g) △H="a" kJ/mol
为研究平衡时CO的转化率与反应物投料比( )及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图:
)及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图:
(1)反应热a 0 (填“>”或“<”),判断依据是。
(2)若其它条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
①投料比:ⅠⅡ (填“>”或“<”)。
②若Ⅱ反应的n(CO)起始 ="10" mol、投料比为0.5,
A点的平衡常数KA=,
B点的平衡常数KBKA (填“>”或“<”或“=”)。
(3)为提高CO转化率可采取的措施是(至少答出两条)。
制作软质隐形眼镜高分子材料(M)和聚酯PET的合成路线如下:
已知酯与醇可发生如下酯交换反应:
(R、R′、R″代表有机基团)
(1)A的相对分子质量是28,A、B分子中含有的官能团分别是。
(2)B的名称是。
(3)反应I的反应类型是_______(选填字母)。
a.加聚反应b.缩聚反应
(4)有关B、C、D的说法正确的是。
a.1mol B最多可以和1 mol C反应
b.C、D都能使Br2的CCl4溶液褪色
c.D与NaOH溶液共热后可以得到B和C
(5)B→D的化学方程式是。
(6)C有多种同分异构体,其中一种是合成纤维维尼纶的单体,该分子在酸性环境下水解得到两种产物,它们的相对分子质量相差16,该同分异构体的结构简式是。
(7)反应II的化学方程式是。
(1)已知:
甲醇制烯烃反应①:2CH3OH(g)=C2H4 (g)+2H2O(g)△H1=-29.0 KJ·mol-1
甲醇脱水反应②:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H2=-24.0 KJ·mol-1
乙醇异构化反应③:CH3CH2OH(g)=CH3OCH3(g))△H3=+50.8 KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
(2)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ、通入氨,冷却、加食盐,过滤;Ⅱ、不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是。而方法Ⅱ的优点是其滤液可以。
(3)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式,电解液中加入Cu(NO3)2的原因是。
溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2·2H2O的主要流程如下: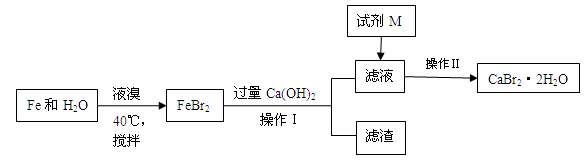
(1)与液溴的反应温度不能超过40℃的原因是。
(2)滤渣的成分可能是。
(3)试剂M是,加入M的目的是。
(4)操作Ⅱ的步骤为蒸发浓缩、、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为。(相对原子质量:Ca—40 Br—80 H—1 O—16)