A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 、 (填写化学式)。
(2)计算电极f上生成的气体在标准状况下体积为 L。
(3)写出乙烧杯中的电解反应方程式: 。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 。
(1)有下列物质:①石墨;②银;③氢氧化钠固体;④稀硫酸;⑤熔融氯化钾;⑥醋酸;⑦液态氯化氢;⑧硫酸钡;⑨氨气;⑩蔗糖。
其中能导电的有;属于电解质的有;属于非电解质的有。
(2)实验证明,下面六种物质是一个氧化还原反应的反应物和生成物:FeSO4,Fe2(SO4)3,Fe(NO3)3,NO,HNO3,H2O,在这六种物质中,产物是,还原剂是,被还原的元素是。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)K1∆H1 < 0(I)
NaNO3(s)+ClNO(g)K1∆H1 < 0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H2 < 0(II)
2ClNO(g) K2∆H2 < 0(II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内 (ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=mol,NO的转化率α1=。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是。
(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=mol,NO的转化率α1=。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是。
氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如下图: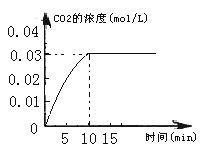
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为;
(3)下列改变中,能使平衡向正反应方向移动的是。
| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
(4)保持温度不变,若起始时c(CO)=1mol·L—1, c(H2O)="2" mol·L—1,反应进行一段时间后,测得H2的浓度为0.4 mol·L—1。通过计算,判断此时该反应进行的方向并说明理由:。
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2) 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________。
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g)△H>0,汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是。假设空气中N2和O2的体积比为4︰1,1300℃时,1mol空气在某密闭容器内反应达到平衡时,测得NO为8×10-4mol,该反应的平衡常数K≈。
(3)汽车燃油不完全燃烧时生成CO,有人设想按下列反应除去CO:2CO(g)=C(s)+O2(g) △H>0,该设想能否实现?(填“能”或“不能”),原因是。
(4)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理:。
(5)某科研机构设计传感器检测CO的含量,其工作原理示意图如下: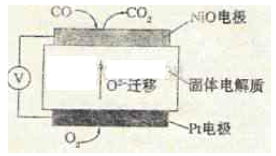
Pt电极上发生的是反应(填“氧化”或“还原”);
写出NiO电极的电极反应式。