(1)今有A、B、C三种二甲苯;将它们分别进行一硝化反应,得到的产物分子式都是C8H9NO2,但A得到两种产物,B得到三种产物,C只得到一种产物。由此可以判断A、B、C各是下列哪一种结构,请将字母填入结构式后面的括号中。
(2)根据分子的相对分子质量M可以推测有机化合物的结构简式。若某种含C、H和卤素的化合物的M为48,写出其结构简式____________
(3)现有某种含C、H和卤素的化合物,测得两个M值,分别为64和66。分别写出它们的结构简式_____________________________________________________________
在推测有机化合物的结构时,可能用到的含量较多的同位素的质量数如下表:
| 元 素 |
H |
C |
F |
Cl |
Br |
| 含量较多的同 位素的质量数 |
1 |
12 |
19 |
35,37 |
79,81 |
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题: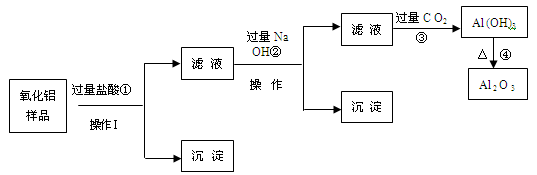
(1)沉淀A的成分是(填化学式),沉淀B的成分是(填化学式);
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为、;
(3)在操作Ⅰ的名称是,其中玻璃棒的作用是。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是________________________________________________________;
(2)实验室用装置E制备Cl2,若有6 mol的HCl参加反应,则转移的电子总数为__________________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:_________________________,D:________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:_________________________,D:________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_____________________________________。
(8分)甲、乙、丙三种物质之间有如下转化关系: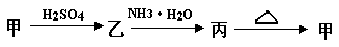
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是____________;写出 乙→丙转化的化学方程式___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________________________;
写出甲→乙转化的离子方程式_______________________________________。
(8分)下列各反应中,通入的气体反应物各起什么作用?请选择下列序号填空:
| A.只做氧化剂 | B.只做还原剂 |
| C.既做氧化剂又做还原剂 | D.既不做氧化剂又不做还原剂 |
(1)氯气通入水中:Cl2+H2O===HCl+HClO______________________
(2)二氧化氮通入水中:3NO2+H2O===2HNO3+NO__________________
(3)二氧化碳气体通入氢氧化钾溶液中:CO2+2KOH===K2CO3+H2O____________
(4)二氧化硫气体通入氢硫酸中:SO2+2H2S="==3S↓" +2H2O_____________________
(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是_____(填“原电池”或“电解池”)。
(2)写出电极反应式:Pt极;
当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色_______(填“变深”、“变浅”或“无变化”)。
(4)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为。(用NA表示)
(Ⅱ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验。
(1)欲使铁制品表面镀铜,应以_______为阳极,电解质溶液为。
(2)以铂作阳极电解溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为。