将下列物质进行分类:① H与
H与 H ②O2与O3 ③乙醇与甲醚(CH3—O—CH3) ④H2O与D2O ⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3 ⑥C60与C35
H ②O2与O3 ③乙醇与甲醚(CH3—O—CH3) ④H2O与D2O ⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3 ⑥C60与C35
(1)互为同位素的是 (填编号、下同);
(2)互为同素异形体的是 ;
(3)互为同分异构体的是 。
【改编】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,E盐溶液为黄色其余水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、E的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,B、E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C的溶液中,均能生成不溶于稀硝酸的沉淀。
⑦分别加热五种盐溶液,无使湿润红色石蕊试剂变蓝的气体生成。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;一定含有的阳离子有_________________________所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为__________________,D溶液与B溶液混合后生成沉淀和气体(用离子方程式表示)____________________________________________
(3)A和C的溶液反应的离子方程式是______________________________________;C和氨水反应生成无色溶液的离子方程式是____________________________________________。
(4)高中阶段检验E中阳离子的方法是__________________________________________向E溶液中加入适量铁粉,溶液颜色改变,其离子方程式为____________________________________。
将0.1 mol的镁、铝混合物溶于100 mL,2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,则金属粉末中n(Mg)=____________mol,n(Al)=____________mol,V2=____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a ,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
(12分)【化学一物质结构与性质】已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_ ______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式_______.
(5)D2B的晶胞如图所示,已知晶体的密度为 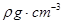 ,阿伏加德罗常数为
,阿伏加德罗常数为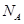 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含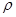 、
、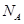 的式子表示)。
的式子表示)。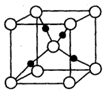
(10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1;由②可知存在的离子为 ,浓度是 mol·L-1;由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。
若多做,则按A小题评分。
【改编】A.[物质结构与性质] 常见金属中钠、镁、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出基态Fe的核外电子排布式 。
(2)[Cu(NH3)2]+是一种常见的配合物
①与NH3互为等电子体的一种阳离子为 (填化学式)。
②[Cu(NH3)2]+中存在的化学键类型有 (填序号)。
A.配位键B.离子键
C.极性共价键 D.非极性共价键
③氨分子的空间构型为 (用文字描述)。
(3)FeCl3的熔点低易升华,而 MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是 。
(4)铜的化合物种类也很多,下图是铜的一种氯化物晶体的晶胞结构,则晶体的化学式为 。