绿色化学的最大特点在于从开始生产时就采取了污染防治的科学手段,实现生产过程的零污染和生产终端的零污染排放,要实现这种生产方式,就必须充分利用资源中的每一个原子,这种理想的生产方式又被称为“原子经济性”。现有甲、乙、丙3个化肥厂生产尿素,所用的原料不同,但生产的流程相似,其中第①反应都是在一定条件下含碳原料与水的反应: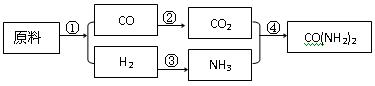
甲厂:以焦炭、空气和水为原料
乙厂:以天然气、空气和水为原料
丙厂:以石脑油(主要成分C5H12)、空气和水为原料
试回答下列问题:
(1)用化学方程式表示乙厂合成尿素的生产过程。
①_______________________________________
②_______________________________________
③_______________________________________
④_______________________________________
(2)3个化肥厂的原料利用率各不相同,试判断化肥厂对原料的利用率最高的是________,简述原因_______________________________________
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
(2)已知:2SO2(g)+O2(g) 2SO3(g)ΔH="-196.6" kJ·mol-1
2SO3(g)ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH="-113.0" kJ·mol-1
2NO2(g)ΔH="-113.0" kJ·mol-1
① 写出NO2氧化SO2的热化学方程式
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
(3)CO可用于合成甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择
此压强的理由是。
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| X |
Y |
Z |
M |
R |
Q |
|
| 原子半径/nm |
0.186 |
0.074 |
0.099 |
0.143 |
||
| 主要化合价 |
-4,+4 |
-2 |
-1,+7 |
+3 |
||
| 其它 |
阳离子核外无电子 |
无机非金属材料的主角 |
焰色反应呈黄色 |
(1)R在元素周期表中的位置是__________________。
(2)Y与R相比,非金属性较强的是(用元素符号表示),下列事实能证明这一结论的是(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性.XR>YX4
c.Y与R形成的化合物中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是__________________.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙+水。若丙的水溶液呈碱性,则丙的化学式是____________或____________.
下图所示反应I、反应II和反应III均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同。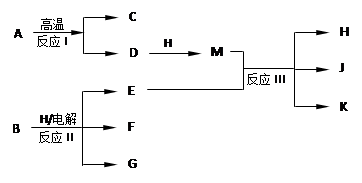
(1)C与J的水溶液反应后生成的含氧酸的电子式是。
(2)E与G反应的离子方程式是
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是。
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果。
①用Na2S2O3标准溶液滴定I2时选用的指示剂是。
②生成I2的反应的离子方程式是。
铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为______________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是__________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO===3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是_ _______(填字母)。
_______(填字母)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铁是地壳中含量最高的 金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
| B |
常温下铁与稀硫酸反应 生成氢气 |
高温下氢气能还原氧化 铁得到铁 |
Ⅰ对;Ⅱ对;无 |
| C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
Ⅰ错;Ⅱ对;无 |
| D |
在空气中铁的表面能形 成致密的氧化膜 |
铁不能与氧气反应 |
Ⅰ对;Ⅱ对;有 |
向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________ ;如果是多种成分,可能是__________________________。
;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示: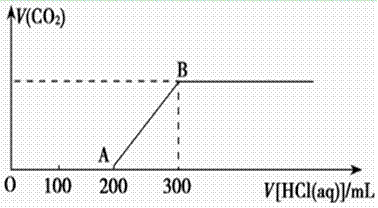
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式_______________ ____________________________________________________。
____________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。