25℃,浓度都是1mol•L-1的四种正盐溶液,其pH情况如下:
| AX |
BX |
AY |
BY |
| pH=7,c(X-)=1mol/L |
pH=4 |
|
pH=6 |
(1)AY溶液pH__________7(填“>”、“<”或“=”);
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX__________HY;若将等体积、等 pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH________BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=_______mol/L;
在AY溶液中:c(A+)-c(Y-)=_________(用一项表示)=_________(用两项表示);
(4)A2Z的水解方程式是_________;_________。
(13分)烯丙醇(CH2=CH—CH2OH)是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
(1)烯丙醇的分子式为 ;烯丙醇中含有的官能团的名称是____。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气__ L。
(3)写出烯丙醇与溴水反应的化学方程式 ,反应类型为___________。
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为 ,酯化反应生成的产物在一定条
件下可以发生加聚反应得到高分子化合物,其结构简式为 。
(4分)现有:①二氧化碳②甲烷③二氧化硫④氢氧化铜。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中。(填序号)
(1)天然气的主要成分是 ;
(2)医院检验糖尿病要用到的物质是新制的 ;
(3)造成温室效应和全球气候变暖的主要物质是 ;
(4)泄漏到空气中而产生酸雨的主要物质是 。
在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答: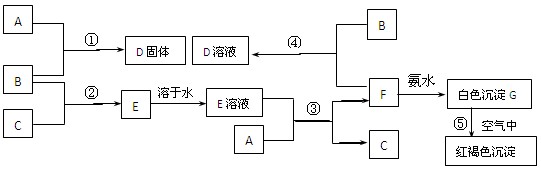
(1)(用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为___________________________________________
反应③的离子方程式为___________________________________________
反应⑤的化学方程式为___________________________________________________
根据要求回答相关问题:
(1)除去下列物质中所混有的少量杂质(括号内为杂质),写出有关的反应方程式。
①铜粉(铝粉) ;
②FeCl3溶液(FeCl2) ;
③N2(O2) 。
(2)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
①写出A→B的化学方程式,标出电子转移的方向和数目________________________
②在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ,主要原因是 ;还可能是 ,主要原因是 。
Ⅰ:有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上可通过下列合成方法制得: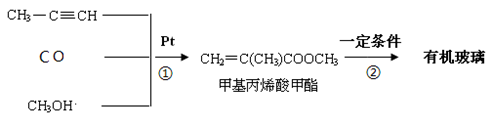
请回答:
(1)反应 ① 的原子利用率是 。
(2)反应 ② 的化学方程式是 。
(3)有机玻璃分子中的链节是 。
Ⅱ:甲基丙烯酸甲酯旧法合成的反应是:
①(CH3)2C=O + HCN (CH3)2C(OH)CN
(CH3)2C(OH)CN
②(CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C(CH3)COOCH3 + NH4HSO4
CH2=C(CH3)COOCH3 + NH4HSO4
(1)该方法的缺点是 (填字母)
A.反应的原料利用率低 B.原料中有有毒物质
C.对设备腐蚀性较大D.生产成本高
(2)甲基丙烯酸甲酯可进行的反应有 (填字母)
A.加成反应B.氧化反应 C.取代反应 D.酯化反应
Ⅲ:将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有浓硫酸的洗气瓶和碱石灰的干燥管,测得洗气瓶的质量增加了2.16 g,干燥管的质量增加了9.24 g,已知该有机物的相对分子质量为108。
(1)该有机物的分子式 。
(2)已知该物质中含有苯环,且1mol该物质与金属钠反应后生产标准状况下氢气0.5mol,满足该条件的同分异构有 种,写出其中苯环上一溴取代同分异构种类最少的该有机物的结构简式 。