过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 | B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 | D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)H2O2体现酸性的反应是(填代号) 。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
(1)与25.5g氨气所含分子数相同的硫化氢的质量是;与25.5g氨气所含原子总数相同的硫化氢在标况下的体积是;与25.5g氨气所含氢原子数相同的硫化氢的质量是。
(2)将2.4克Mg 投入到3mol/L 200mL硫酸溶液中,生成气体在标准状况下的体积为,剩余硫酸的物质的量浓度为。(忽略反应过程中溶液体积的变化)
写出下列物质的电离方程式:
NaHCO3,
CuSO4,
(NH4)2CO3。
储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式:
C+________+H2SO4——________+________+Cr2(SO4)3+H2O
(2)上述反应中氧化剂是________ (填化学式),
(填化学式), 被氧化的元素是________(填元素符号)。
被氧化的元素是________(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)________。
A.氧化性 B.氧化性和酸性 C.酸性D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为____。
如图A、B、C、D、E、F六种物质中除D为单质外其余 均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。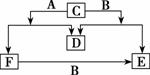
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;
(2)C的电子式是____________________;
(3)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。
甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出三种离子,其中一种离子是由A、B两元素形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入足量NaOH溶液,加热,部分实验现象如下:产生有刺激气味的气体;
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是 ,D在周期表中的位置: 周期 族
(2)用离子方程式表示实验②中现象的原因:。
(3)实验③中出现的现象还有 。
(4)经测定甲晶体的摩尔质量为284 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。