在下列用途或反应中,硫酸表现出的性质为:
| A.高沸点; | B.强酸; | C.吸水性; | D.脱水性;E.强氧化性。试用字母填空: |
(1)实验室制取氢气________________;(2)干燥氢气________________;
(3)浓硫酸溶解金属铜________________;(4)浓硫酸可用钢瓶贮运_____;
(5)硫酸使蔗糖变黑_______________;
X、Y、Z、W、M五种元素中X、Y、Z、M为短周期主族元素,W是一种常见的金属。
①四种短周期元素中有两种元素在同一主族。
②X的核电荷数比Y少2个。
③五种元素中M的原子序数最小,且核外电子层数和其它元素核外电子层数都不同。
④五种元素中有两种元素可以形成AB型、A2B3型、A3B4型等多种化合物。
⑤X和Y可以形成XY、XY2等化合物。
⑥Z和W可以形成WZ、WZ2等化合物。
请回答:
(1)④中能形成AB型、A2B3型、A3B4型化合物的元素是 。
(2)甲、乙、丙三种常见的可燃气体是由这五种元素中的一种或多种元素组成的。甲、乙、丙燃烧时都发出蓝色或淡蓝色火焰,甲、乙、丙的化学式是 、 、 。
(3)很多反应都可以生成M单质,请再写出两个生成M单质反应的化学方程式。(要求:参加反应的物质由五种元素中的一种或多种元素组成;反应条件不同于实验室制取M单质的反应条件) 、 。
(4)已知WZ2可以在高温条件下和空气中的氧气反应,1mol WZ2充分反应,放出853 kJ的热量。该反应的热化学方程式是 。
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
| A.h的最高价氧化物对应的水化物是一种强碱 |
| B.硒化氢的稳定性强于f的氢化物的稳定性 |
| C.c的氢化物的水溶液是强酸 |
| D.原子半径:h>e>a |
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为。
在一定的温度下,对于反应2A(g)+B(g)2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如图所示,现从t1时间开始对反应体系升高温度,n(C)的变化如图所示。试回答下列问题:
(1)p点时反应的v正 v逆(选填“>”、“<”或“=”)。
(2)此反应的正反应为 热反应(填“放”或“吸”)。
(3)a、b两点的正反应速率:va vb(“>”、“<”或“=”)。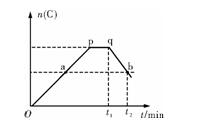
将0.65克Zn粉加入到200ml的足量CuSO4溶液中,锌粉完全溶解,(不考虑反应前后溶液体积的变化)求:
(1)析出铜的物质的量;(2分,写出计算过程)
(2)生成ZnSO4的物质的量及其物质的量浓度;(4分,写出计算过程)
(3)溶液的质量是增加了还是减少了,变化了多少克,说明理由;
有A、B、C、D四种化合物,其中A、C、D为盐且焰色反应均为黄色,而B是碱且透过钴玻璃观察焰色反应为紫色,A、C和盐酸反应均得到D的溶液,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸铜中溶液会出现蓝色沉淀E。试推断(写化学式)
A:________、B:________、C:_________、D:_________、E: