(10分) 莽草酸具有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体。莽草酸可以实现下列转化:
已知:①
请回答下列问题。
(1)A的结构简式是 。
(2)B C的化学方程式是
C的化学方程式是
。
反应类型是 反应。
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原
子。E分子中手性碳原子有 个。
(4)莽草酸经过中间产物D合成E的目的是 。
(1)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。甲、乙两元素相比较,金属性较强的是(填名称),
可以验证该结论的实验是。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)通常情况下,微粒X和Y为分子,Z和W为阳离子,E为阴离子,它们都含有10个电子;
Y溶于X后所得的物质可电离出Z和E;X、Y、W三种微粒反应后可得Z和一种白色沉淀。请回答:
①用化学符号表示下列4种微粒:
X:Y :Z:E :
②写出两个X、Y、W三种微粒反应的离子方程式:
、
氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等,已知N2H5+与N2H62+是由中性分子X结合H+形成的,有类似于NH4+的性质。
(1)1个N3-离子含有个电子;
(2)形成N2H5+离子的中性分子X的分子式是;
X在氧气中可以燃烧,写出燃烧反应的化学方程式;
(3)写出N2H62+离子在强碱溶液中反应的离子方程式。
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。出下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为l :1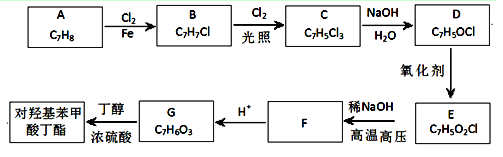
回答下列问题:
(1)A的化学名称为
(2)由B生成C的化学反应方程式为该反应的类型为
(3)D的结构简式为
(4)F的分子式为
(5)G的结构简式为
(6)E的同分异构体中含有苯环且能发生银镜反应的共有种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1,的是(写结构简式)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
(1)卤族元素位于周期表的_________区;溴的价电子排布式为______________
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是_______
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___
| 氟 |
氯 |
溴 |
碘 |
铍 |
|
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(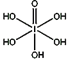 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4(填“>”、 “<”或“=”)
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的分子式__________(写出1个)
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________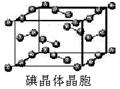
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配 位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料[ 已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455kJ/mol ]。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚; 2CH3OH  CH3OCH3+H2O
CH3OCH3+H2O
②合成气CO与H2直接合成二甲醚: 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)△H=-247kJ/mol
CH3OCH3(g)+CO2(g)△H=-247kJ/mol
③天然气与水蒸气反应制备二甲醚。以CH4和H2O为原料制备二甲醚和甲醇工业流程如下:
(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式(结果保留一位小数)
(2)在反应室2中,一定条件下发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
A.低温高压 B.加催化剂 C.增加CO浓度 D.分离出二甲醚
(3)在反应室3中,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)  CH3OH(g)+H2O (g)△H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是(填序号)
CH3OH(g)+H2O (g)△H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是(填序号)
A.P3>P2 T3>T2 B.P2>P4 T4>T2
C.P1>P3 T1>T3D.P1>P4 T2>T3
(4)反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)△H>0
CO(g)+3H2(g)△H>0
写出平衡常数的表达式:
如果温度降低,该反应的平衡常数
(填“不变”、“变大”、“变小”)
(5)下图为绿色电源“二甲醚燃料电池”的工作原理示意图则a电极的反应式为:________________
(6)下列判断中正确的是_______
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ =2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H++ 4eˉ = 2H2O,溶液pH降低