含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目
。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子方程式
。
患者被送往医院后,医生往往让其服用
(填题干所列7种物质中的1种)来解毒。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
,
则发生了钝化;若铁棒表面 ,则未发生反应。
Heck反应是合成C-C键的有效方法之一,如反应①:
IⅡⅢ
化合物Ⅱ可由以下合成路线获得:
(1) 化合物Ⅲ的分子式为________,1 mol化合物Ⅲ最多可与______mol H2发生加成反应。
(2)化合物IV分子结构中有甲基,写出由化合物IV反应生成化合物V的化学方程式________________________________________________________________。
(3)有关化合物Ⅱ说法正确的是____________
| A.1 mol 化合物Ⅱ完全燃烧消耗5 mol O2 |
| B.化合物Ⅱ能使酸性高锰酸钾溶液褪色 |
| C.化合物Ⅱ难溶于水 |
D.化合物Ⅱ分子间聚合,反应生成的高聚物结构为 |
(4)化合物Ⅲ的一种同分异构体VI,苯环上的一氯取代物有两种,VI能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1:1:1:3,V的结构简式为________________。
(5) 和
和 也可以发生类似反应①的反应,有机产物的结构简式为_______________。
也可以发生类似反应①的反应,有机产物的结构简式为_______________。
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿(主要成份:CuO ZnO)的方案,实现废物综合利用,方案如下图所示。
请回答下列问题:
(1)操作1的名称是:
(2)向溶液A中加入Fe粉发生的主要的反应离子方程式为:、。
(3)向溶液B中加入物质X的目的是,物质X可用下列物质中的。(填字母)
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
(4)向溶液B中加入氨水的目的是调节溶液的pH,pH应控制在范围之间。
(5)溶液D中主要溶质的化学式是。
(6)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”)。
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。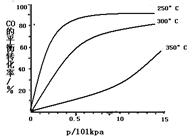
(1)NO2可用水吸收,相应的化学反应方程式为 。
利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol
2NO2(g) ΔH="-113.0" kJ·mol
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
试回答下列问题:
(1)化合物I与CH3CHO所发生的有机反应类型是
(2)化合物III在银氨溶液中发生反应化学方程式
(3)下列说法正确的是(双选)
| A.化合物I遇氯化铁溶液呈紫色 |
| B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物IV完全燃烧消耗9.5molO2 |
| D.1mol化合物III能与3 mol H2反应 |
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。
请写出化合物X的结构简式(写出两种)
(5)有机物R(如图)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为。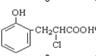
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
将KMnO4 氧化Fe2+的离子方程式补充完整: MnO4-+□Fe2++□ =
MnO4-+□Fe2++□ = Mn2++□Fe3+ +□
Mn2++□Fe3+ +□
上式中氧化剂是 ,氧化产物是 。
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
②Ⅳ 中加入MnSO4的目的是 。