奶油中有一种只含的化合物 。可用作香料,其相对分子质量为88,分子中原子个数比为2:4:1 。
(1)的分子式为_。
(2)写出与分子式相同的所有酯的结构简式:
。
已知:
中含有碳氧双键,与相关的反应如下:

(3)写出、的反应类型:、。
(4)写出、、的结构简式:、 、。
(5)写出反应的化学方程式:。
(6)在空气中长时间搅拌奶油,可转化为相对分子质量为86的化合物,的一氯代物只有一种,写出的结构简式:。的反应类型为。
(12分)碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1的Na2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O ),消耗25.00 mL。
),消耗25.00 mL。
②另取1.685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。
(1)步骤①需要用到的指示剂是________。
(2)步骤②若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将________(填“偏高”“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。
(15分)有机物H是一种新型大环芳酰胺的合成原料,可通过以下方法合成: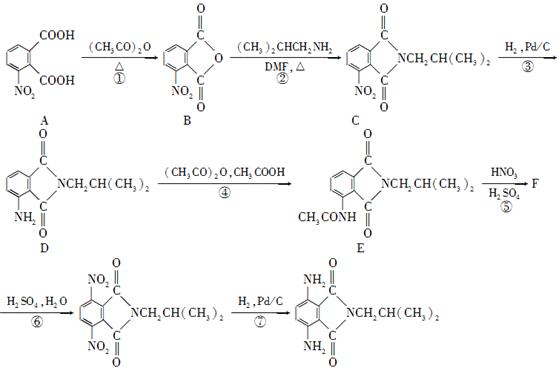
已知:①苯胺( )有还原性,易被氧化;
)有还原性,易被氧化;
②硝基苯直接硝化主要产物为间二硝基苯。
(1)写出A中含氧官能团的名称:________和________。
(2)写出F的结构简式:________。
(3)步骤④和步骤⑥的目的是____。
(4)写出一种符合下列条件的化合物C的同分异构体的结构简式:____。
①分子中含有2个苯环;
②能与FeCl3溶液发生显色反应;
⑧分子中有3种不同化学环境的氢原子。
(5)对苯二胺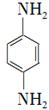 )是一种重要的染料中间体。根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)是一种重要的染料中间体。根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
(12分)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90℃而不在室温下进行的原因是____。
(2)“酸溶”时,Al2O3发生反应的离子方程式为____。
(3)“氧化”时,发生反应的离子方程式为____。
(4)“废渣”成分为________(填化学式)。
(5)采用喷雾干燥而不用蒸发的原因是____。
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g)△H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其发生可逆反应的方程式为。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,请写出该电极反应的方程式为。
Ⅰ.有机物A的结构简式为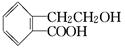 ,它可通过不同化学反应分别制得B、C和D三种物质。
,它可通过不同化学反应分别制得B、C和D三种物质。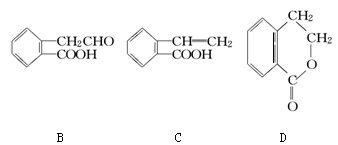
(1)B中含氧官能团的名称是________。
(2)A →C的反应类型是________;A~D中互为同分异构体的是________。
(3)由A生成B的化学方程式是______________________________________。
Ⅱ.某芳香族化合物H常用作防腐剂,H可利用下列路线合成:
已知:①A是相对分子质量为92的烃;
②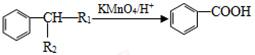
③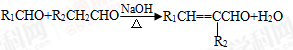 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);
④D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________。
(2)同时符合下列条件的E的同分异构体共有____________种。
①分子中含有苯环
②能发生银镜反应
③能与FeCl3溶液发生显色反应
(3)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为______。
(4)H的结构简式为_____________________________________。