海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、 、 可制得精盐。
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下: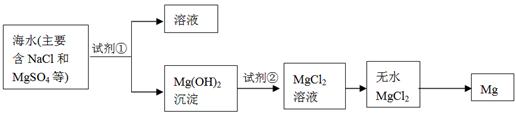
①为了使MgSO4转化为Mg(OH) 2,试剂①可以选用 ,要使MgSO4完全转化为沉淀,加入试剂①的量应 ;
②试剂②可以选用 ;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是 。
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下: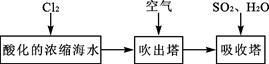
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):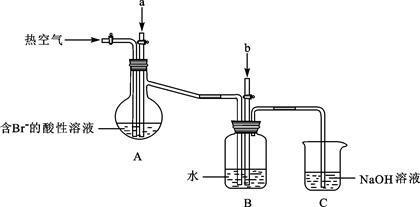
①A装置中通入a气体的目的是(用离子方程式表示) ;
②A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是
;
③反应过程中,B装置中有SO42-生成。检验SO42-的方法是 ;
④C装置的作用是 。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4 溶液。(1)请完成下表:
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
(2)装置B的作用是。
(3)经小组讨论并验证该无色气体为O2,其验证方法是。
(4)【查阅资料】Ag2O和Ag的粉末均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为。
【实验拓展】测得两组数据:
①取2.0gAgNO3样品充分受热分解,收集到气体体积为56mL;
②取2.0gAgNO3样品充分受热分解,完全分解后测得残留固体产物质量为1.2g;请你选择其中一组数
据,计算样品中AgNO3的百分含量为。
实验室要用98%(密度为1.84 g·cm-3)的硫酸配制3.68 mol/L的硫酸500 mL。
若配制3.68 mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是___。
| A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切 |
| D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有。
(2)实验中要持续通入氮气,否则测出的x会(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式。
(5)装置D球形干燥管的作用。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x=。
某食用白醋是由醋酸与纯水配制而成,用0.1000 mol/L NaOH溶液准确测定其中醋酸的物质的量浓度。以下为某同学列出的实验步骤(未排序),请回答下列问题。
| A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm |
| B.调节滴定管液面至0或0刻度以下,记下读数 |
| C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度 |
| D.用标准液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次 |
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00 mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理。
(2)从上述实验步骤中选出正确的并按操作先后排序。你的实验顺序为:(用字母表示)。
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是________,滴定终点的现象是_________________________________。
(4)某同学实验后得到的数据如下:
| 滴定次数 实验数据 |
1 |
2 |
3 |
4 |
5 |
| V(NaOH) /mL(初读数) |
0.00 |
0.20 |
0.00 |
0.10 |
0.05 |
| V(NaOH) /mL(终读数) |
15.75 |
15.20 |
14.98 |
15.12 |
15.05 |
原白醋中醋酸的物质的量浓度为________mol/L(结果保留4位有效数字)。
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空。
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡_______;
②读取标准溶液体积时,滴定前平视,滴定后仰视________。
实验室常用Na2O2与H2O反应快速制取少量O2。用下面装置制取O2并演示Na在O2中的燃烧实验。
请回答下列问题:
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气(填“漏气”“不漏气”或“无法确定”),判断理由是。
(2)写出A装置中反应的化学方程式并用双线桥或单线桥标出电子转移情况:。
(3)C装置中观察到的现象是。
(4)D装置中盛放的试剂是,其作用是。