为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4 溶液。(1)请完成下表:
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
(2)装置B的作用是 。
(3)经小组讨论并验证该无色气体为O2,其验证方法是 。
(4)【查阅资料】Ag2O和Ag的粉末均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为 。
【实验拓展】测得两组数据:
①取2.0gAgNO3样品充分受热分解,收集到气体体积为56mL;
②取2.0gAgNO3样品充分受热分解,完全分解后测得残留固体产物质量为1.2g;请你选择其中一组数
据,计算样品中AgNO3的百分含量为 。
某化学小组采用下图装置模拟电解饱和食盐水制备氢气,通过氢气还原氧化铜测定Cu的相对原子质量,同时检验氯气的氧化性(图中夹持和加热仪器已经略去)。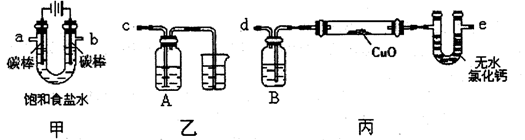
(1)写出装置甲中反应的离子方程式。为完成上述实验,正确的连按方式为a连接,b连接(填字母)。
(2)①装置乙烧杯中液体的作用是。A瓶内盛装的溶液最好是(填字母)。
a.I-淀粉溶液b.NaOH溶液
c.FeCl2与KSCN混合溶液 d.Na2SO3溶液
②加热装置丙中的氧化铜粉末之前,除了要检查该装置的气密性还需进行的必要操作是。
(3)利用装置丙测定Cu的相对原子质量,现有两种方案:①测得反应前后洗气瓶B及其中液体质量差m1,②测得反应前后U形管及其中固体质量差m2。你认为合理的方案为(填“①”或“②”)。若采用测得反应后硬质玻璃管中剩余固体的质量m3的方案,已知O的相对原子质量为16,实验中氧化铜样品质量为m,则测定Cu的相对原子质量的表达式为,该方案在反应后硬质玻璃管冷却过程中没有一直通氢气,会导致测定Cu韵相对原子质量(填“偏大”、“偏小”或“无影响”),理由是。
某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为__(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更(填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为____________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更(填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→____→____→____→____→____→____→h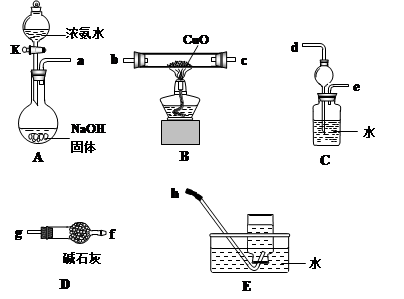
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为______________________。
③装置C中的球形装置的作用是_________________。
氮化铝(AIN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计下图实验装置。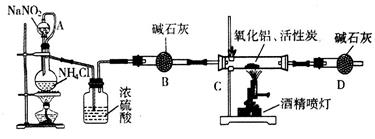
试回答:
(1)实验中用饱和NaNO2与 NH4C溶液制取氮气的化学方程式为。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是(填写序号)。
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是。
(4)化学研究小组的装置存在严重问题,请说明改进的办法。
(5)反应结束后,某同学用下图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气 。
。
①广口瓶中的试剂X最好选用(填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将(填“偏大”、“偏小”、“不变”)。
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为。
工业生产纯碱的过程如下:
完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B 的化学式为。
(2)实验室模拟由滤液制备滤渣的装置如下:
①图1中装置和图2中装置的连接方法为a接,b接,f接c。
②图2中试剂瓶内发生的化学反应方程式为。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是。
(3)操作⑤煅烧后的纯碱中含有未分解的碳酸氢钠。某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为。
(4)现有25℃下,0.1mol/LNH3·H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是(填代号)。
a.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3·H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。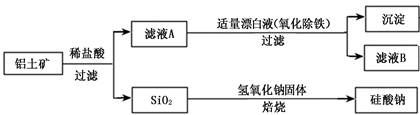
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+=□Fe(OH)3↓+□C1-+
②检验滤液B中是否还含有铁元素的方法为:(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、(填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O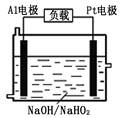
①正极反应式为。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的
原因之一,电极被腐蚀的离子方程式为。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。