实验室常用Na2O2与H2O反应快速制取少量O2。用下面装置制取O2并演示Na在O2中的燃烧实验。
请回答下列问题:
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气 (填“漏气”“不漏气”或“无法确定”),判断理由是 。
(2)写出A装置中反应的化学方程式并用双线桥或单线桥标出电子转移情况: 。
(3)C装置中观察到的现象是 。
(4)D装置中盛放的试剂是 ,其作用是 。
(12分)实验室有一瓶密封不严的漂白粉,请利用以下仪器和试剂,完成该漂白粉成分的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。
(1) 提出假设:假设一:该漂白粉未变质,含________________________。
假设二:该漂白粉全部变质,含________________________。
假设三:该漂白粉部分变质,含CaCl2 , Ca(ClO)2 ,CaCO3
(2)进行实验:在答题卡上完成下表(不必检验Ca2+、Cl-)
| 实验步骤 |
预期现象和结论 |
|
| ① |
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管加入__________ |
若无气体放出且澄清石灰水未见浑浊,则假设________成立: |
| ② |
||
| ③ |
(20分)A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题: ( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为____;
(3)⑤的化学方程式是_____________________________________________;
⑨的化学方程式是______________________________________________;
(4)③的反应类型是______,④的反应类型是_____,⑦的反应类型是________;
(5)与H具有相同官能团的H的同分异构体的结构简式为______________。
(共9分)现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。回答有关问题:
(共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
①气体X的分子式是。
②所选择的药品a是,b是, c是。
③下列装置乙和丙,能代替装置甲的简易装置是(填“乙”或“丙”)
④请写出在试管a中所发生反应的化学方程式。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出;;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为(填“正确”或“不正确”),依据是:;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象:。
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)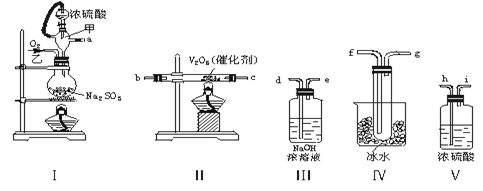
(1)这些装置的连接顺序(按气体左右的方向)是→→→→→→→→(填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是。
(4)Ⅳ处观察到的现象是。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为。