工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。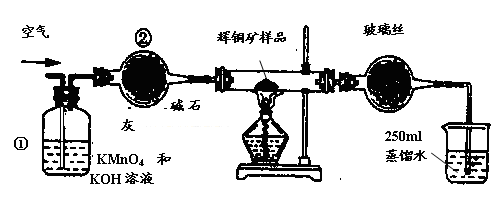
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定 次数 |
待测溶液的 体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.04 |
21.03 |
| 2 |
25.00 |
1.98 |
21.99 |
| 3 |
25.00 |
3.20 |
21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是(写一种既可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________。
某化学小组在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下。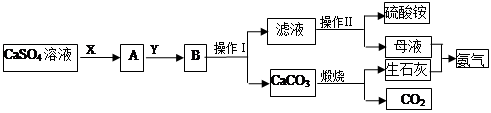
回答下列问题:
(1)操作Ⅰ的名称为_________;操作Ⅱ一系列操作包括蒸发浓缩、________、过滤。
(2)实验室中煅烧碳酸钙时,盛放碳酸钙所用的仪器是________(填名称)。
(3)X物质为____(填化学式,下同),Y物质为____,可循环利用的物质的有_____。
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后称量固体的质量为16.31g。为避免引起误差,检验氯化钡溶液是否过量最好的试剂是_______,所制得硫酸铵的纯度为________。
(5)下列装置不能用于实验室制氨气的是__________(填序号)。
选择氨气的制取装置后,再用下列装置收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接____,____接____,____接_____,____接_____。
上述装置中CCl4的作用是___________________。
实验室用下述装置制取氯气,并用氯气进行下列实验。 回答下列问题:
(1)A、B两仪器的名称:A_________________,B________________。
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是________________,D中浓H2SO4的作用是________________。
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是 _______。(填E或F)
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______________。
H是浸有NaBr溶液的棉花球,H处反应的离子方程式是___________________________________________。
(5)P处为尾气吸收装置, 写出实验室利用烧碱溶液吸取Cl2的离子方程式: ___________________。
(6)B中发生反应的化学方程式为_______________________ ,若实验中使用12 mol·L-1的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,试分析可能存在的原因是______________________________________________________。
某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用作指示剂。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为mL;反应达滴定终点时的现象为。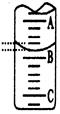
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不用化简):C1=mol/L。
(15分)阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是________________。
(2)①合成阿司匹林时,最合适的加热方法是__________________________。
②加热后冷却,未发现被冷却容器中有晶体析出,此时应采取的措施是_________________。
③抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是____________________。
(3)另一种改进的提纯方法,称为重结晶提纯法。方法如下:
改进的提纯方法中加热回流的装置如图所示。
①使用温度计的目的是________________;
②此种提纯方法中乙酸乙酯的作用是________________,所得产品的有机杂质要比原方案少,原因是___________________________________。