工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。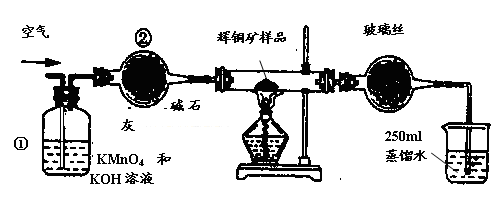
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定 次数 |
待测溶液的 体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.04 |
21.03 |
| 2 |
25.00 |
1.98 |
21.99 |
| 3 |
25.00 |
3.20 |
21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种既可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________。
已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。(汞在常温下是液态)
 (1)步骤1的主要操作是,需用到的玻璃仪器除烧杯外有。
(1)步骤1的主要操作是,需用到的玻璃仪器除烧杯外有。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式),固体残渣的成分是(填化学式);加入的试剂必须要过量,原因是:
(3)步骤3中涉及的操作是:蒸发浓缩、、过滤、烘干。
现用质量分数为98%.密度为1.84 g/ml的浓硫酸来配制500ml0.2mol/l的稀硫酸,可供选择的仪器如下;①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙请回答下列问题。
(1)上述仪器中,在配制稀硫酸时用不到的仪器有(填序号)
(2)经计算,需浓硫酸的体积为。现有①10ml.②50ml.③100ml三种规格的量筒,你选用的量筒是(填序号)
(3)将浓硫酸稀释后,冷却片刻,随后全部转移到ml的容量瓶中,转移时应用玻璃棒,转移完毕后,用少量蒸馏水洗涤烧杯玻璃棒2~3次,并将洗涤液也转入容量瓶中,在加适量蒸馏水直到液面接近刻线处。改用滴加蒸馏水到瓶颈刻度的地方,将溶液振荡,摇匀后,装瓶,贴签。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏高、偏低、无影响填写)
A、容量瓶用蒸馏水洗涤后未干燥_________________;
B、所用的浓硫酸长时间放置在敞口容器内_________________;
C、定容时仰视溶液的凹液面_________________;
Fe在地壳中的含量虽次于铝,但铁及其化合物在生活、生产中的应用最广泛。请回答下列问题:
(1)Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备铁酸钠的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
| A.Na2O2在反应中只作氧化剂 |
| B.Na2FeO4既是氧化物又是还原产物 |
| C.O2是还原产物 |
| D.2molFeSO4发生反应时,反应中共有8mol电子转移 |
(2)硫酸亚铁晶体(FeSO4·7H2O),俗称“绿矾”,常作医药上的补血剂。课外研究性小组测定某片状补血药品中铁元素的含量。实验步骤如下:
请回答下列问题:
①该小组发现将片状补血剂长 时间置于空气中,表面“发黄”,请用化学方程式表示原因。
时间置于空气中,表面“发黄”,请用化学方程式表示原因。
②课外研究性小组发现在滤液A中滴入少量KClO溶液,并加入适量硫酸,溶液立即变黄。
甲同学推测该反应的还原产物有两种可能:①Cl2、②Cl-
乙同学结合甲的推测,认为其中一种可能可以排除,你认为可以排除的是(填序号);用离子方程式说明理由。
③若该实验温度下,上述红褐色难溶物质的溶度积为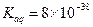 试计算该物质沉淀完全所需要的pH=(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
试计算该物质沉淀完全所需要的pH=(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
④若实验过程中无损耗,最后称量得到mg红棕色的固体,则每片补血剂中含铁元素的质量为g(用含m的式子表示)
⑤丙同学认为蒸干灼烧溶液B,也可以制得红棕色固体C,请结合化学方程式加以说明
。
某课外兴趣小组的同学向Na2SiO3溶液中滴加盐酸,预计会生成H2SiO3胶体,用激光笔照射会出现“丁达尔现象”。但令人意想不到的是,试管中在出现硅酸胶体的同时也出现了大量气泡,为什么会出现这种现象呢?甲乙两同学进行了大胆的推测。
甲同学推测是生成了硅酸胶体,造成HCl在溶液中的溶解度变小,最终从溶液中逸出;
乙同学咨询了实验员得知这瓶Na2SiO3溶液已经放置很长一段时间,他推测溶液可能已经变质,故导致以上现象的出现。
(1)请设计一个最简单的实验验证甲同学的推测是否正确:;
(2)乙同学取这瓶久置的硅酸钠溶液,用激光笔照射,发现有光柱出现,说明在这瓶硅酸钠溶液中已经有胶体生成。推测产生的气体可能是,然后乙同学又做了两个实验进行验证:
I取少量该瓶溶液,向其中滴加,并检验产生的气体。请写出检验该气体的常用方法:;
II取硅酸钠固体,配成饱和溶液,现配现用,滴入盐酸,观察现象;
通过以上实验,证明了乙同学观点,请写出所对应的化学反应方程式:
、;
该小组同学还发现按教材所述的操作方法和条件制备硅酸胶体,有时需要很长时间才能使溶胶慢慢凝聚,甚至不易形成凝胶,效果很不理想。因此,该组同学又对实验条件和操作进行探究,相关实验数据如下表:
| 硅酸钠溶液浓度 |
盐酸浓度 |
试剂加入顺序 |
出现凝胶时间(s) |
|
| 实验1 |
饱和溶液 |
1:2(盐酸和水体积比,下同) |
将Na2SiO3溶液滴加到稀盐酸中 |
21 |
| 实验2 |
稀溶液(1体积饱和溶液和3体积水混合) |
1:2 |
将稀盐酸滴加到Na2SiO3溶液中 |
38 |
| 实验3 |
饱和溶液 |
1:4 |
将Na2SiO3溶液滴加到稀盐酸中 |
10 |
| 实验4 |
稀溶液(1体积饱和溶液和3体积水混合) |
1:4 |
将稀盐酸滴加到Na2SiO3溶液中 |
50 |
该组部分同学通过实验得出结论:使用饱和Na2SiO3溶液和稀盐酸,将Na2SiO3溶液滴加到稀盐酸中效果较好。但该组另外一部分同学认为基于限定的条件,该探究实验设计组数不够,不能保证结论的准确性,要使实验具有说服力至少要做组实验。
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
| 沉淀物 |
开始沉淀时的pH |
沉淀完全时的pH |
| Mg(OH)2 |
9.6 |
11.1 |
| Fe(OH)3 |
2.7 |
3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| …… |