(20分)A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题: ( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为____;
(3)⑤的化学方程式是_____________________________________________;
⑨的化学方程式是______________________________________________;
(4)③的反应类型是______,④的反应类型是_____,⑦的反应类型是________;
(5)与H具有相同官能团的H的同分异构体的结构简式为______________。
共12分)
(一)为了达到下表中的实验要求,请选择合适的试剂及方法,将其标号填入对应的空格中。
| 实验要求 |
试剂及方法 |
||
| 鉴别Na2SO4溶液和NaCl溶液 |
A.分别加入氯化钡溶液,观察现象 |
||
| 证明盐酸溶液呈酸性 |
B.将气体分别通过盛有品红溶液的洗气瓶 |
||
| 鉴别二氧化硫和二氧化碳 |
C.加入几滴碘水,观察现象 |
||
| 检验淘米水中是否含有淀粉 |
D.在溶液滴加紫色石蕊,溶液变红 |
||
(二).甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物 . 
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
| 实验操作 |
实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. |
|
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. |
无明显现象. |
| 加热烧瓶,反应开始后停止加热. |
①A中有红棕色气体产生,一段时间后,B中溶液变棕色;C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是.
(3)证明A溶液中是否含有Fe3+,选择的药品是(填序号)()
A.铁粉B.溴水C.铁氰化钾溶液D.硫氰化钾溶液.
4)根据实验现象写出A中一定发生反应的化学方程式
某学生用0.1 mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.OOmL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或O刻度以下,记下读数
(F)把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空;
(1)正确操作的顺序是(用序号字母填写)_________.
(2)上述(B)操作的目的是_________。
(3)实验中用左手控制_________(填仪器及部位),眼睛注视______________________,
直至滴定终点。判断到达终点的现象是__________。
(4)下列情况使结果偏高的是___________________________.
①碱式滴定管用水洗后直接装液体进行滴定;②酸式滴定管水洗后,就用来量取待测盐酸;③锥形瓶用蒸馏水洗涤后,又用待测盐酸润洗;④将待测酸液溅到锥形瓶外;⑤碱液在滴定时滴到锥形瓶外;⑥若称取含少量NaOH的KOH固体配制标准溶液并用来滴定上述盐酸;⑦滴定前,碱式滴定管有气泡,滴定后消失;⑧记录标准碱液起始体积时,仰视读数,终点时俯视。
下图是实验室中制备气体或验证气体性质的装置图。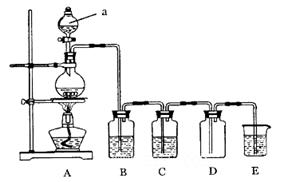
(1)仪器a的名称是_________________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为________________________________________;
②装置B中溶液为________________,烧杯E中溶液的作用为_______________________。
(3)利用图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是_______________,现象是______________________;
②证明SO2具有还原性的现象是_____________________________________________;
③证明生成气体中含有CO2的现象是_________________________________________;
④D装置的作用是________________________________________。
NaCI在生活、生产和科研中都有广泛的用途。
I.从海水中提取的粗盐含有Ca2+、Mg2+、SO42-等离子,为制备精盐可使用以下四种试剂:①Na2CO3溶液②BaCl2溶液③NaOH溶液④盐酸(用于沉淀的试剂均稍过量)。
(1)加入试剂的合理顺序是__________(填选项)。
A.①②③④ B.③①②④ C.②①③④ D.③②①④
(2)加入过量Na2CO3溶液的作用是________。
II.实验室要配制100 mL 0.2 mol NaCl溶液。
NaCl溶液。
(1)用托盘天平称氯化钠固体的质量是______g。
(2)配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)下列操作中,可能造成所配制溶液的浓度偏低的是________(填选项)。
A.没有洗涤烧杯和玻璃棒 b.定容时,俯视刻度线
C.洗涤后的容量瓶中残留少量蒸馏水
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3 FeCO3↓+Na2SO4FeCO3+C6H8O7
FeCO3↓+Na2SO4FeCO3+C6H8O7 FeC6H6O7+CO2↑+H2O
FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Al3+ |
3.0 |
5.0 |
| Fe2+ |
5.8 |
8.8 |
(1) 制备FeCO3时,选用的加料方式是 (填字母)
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法____________________
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是 。
②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。结合下图的绿矾溶解度曲线,完成由烧渣制备绿矾晶体的操作
绿矾溶解度曲线
试剂i_________加入试剂i反应的离子方程式为 ________________________________
操作a为__________________________、____________________、_________________