今有下列两组单质,试将每组单质从不同角度进行“分类”,每种“分类”都可分别挑出一种单质,它跟其他三种单质属于不同的“类”,将挑出的单质(写化学符号)和挑选依据(写编码)列在下面相应的表格内:
两组单质为:Ⅰ.O2、F2、S、N2 Ⅱ.Fe、Na、Al、Si
“挑选依据”仅限于下述六种。该被挑出的单质跟其他三种单质不同,是由于:
| A.其组成元素不属于金属(或非金属); | B.其组成元素不属于周期表中的同一族; | C.其组成元素不属于周期表中的同一周期; | D.其组成元素不属于主族(或副族)元素;(E)在常温常压下呈不同物态;(F)在常温下遇水能(或不能)迅速产生气体。 |
| |
答案1 |
答案2 |
答案3 |
答案4 |
答案5 |
答案6 |
| 单质 |
Si |
|
|
|
|
|
| 挑选依据 |
A |
|
|
|
|
|
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g)△H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g)△H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如下图所示。已知:
(1)Mr(R-Cl)-Mr(ROH)=18.5,Mr(RCH2OH)-Mr(RCHO)=2,Mr表示相对分子质量;
(2) 中的—OH不能被氧化。
中的—OH不能被氧化。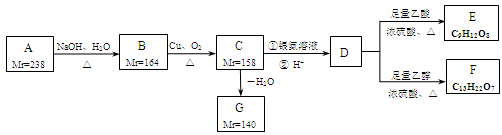
A中只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,峰面积之比为1:3:6,且D中不含甲基,请回答下列问题:
(1)A中含有的官能团是。
(2)写出D的分子式。
(3)下列有关A~G的说法正确的是。
a.每个A分子中含有官能团的数目为4个
b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物
d.G存在顺反异构现象
(4)写出B生成C的化学方程式。
(5)芳香族化合物H与G互为同分异构体,1 mol H与足量氢氧化钠溶液反应消耗2 mol NaOH,则H共有种属于芳香族化合物的同分异构体,若H苯环上的一氯代物只有两种,且1 mol H与足量的钠反应产生1.5 mol氢气,写出其中任意一种符合条件的H的结构简式。
(6)E与足量NaOH溶液共热,此反应的化学方程式为。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: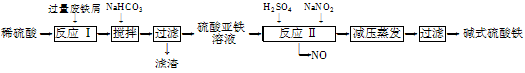
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是。
(3)反应Ⅱ的离子方程式为。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为。
A.氯水B.KSCN溶液C.NaOH溶液D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为。
A.22.1 gB.27.2 gC.30 gD.无法确定
Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
据此判断:
(1)该反应的ΔH0(选填“>”、“<”)。
(2)若在一定温度下,将1.0 mol NO、0.5 mol CO充入0.5 L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8 mol、0.3 mol、0.2 mol、0.1 mol,该反应的化学平衡常数为K=;若保持温度不变,再向容器中充入CO、N2各0.3 mol,平衡将移动(选填“向左”、“向右”或“不”)。
Ⅱ.以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
回答下列问题:
(1)B极为电池极,电极反应式为。
(2)若用该燃料电池做电源,用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为(标况下)。
Ⅲ.FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为。