工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: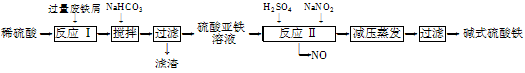
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是 。
(3)反应Ⅱ的离子方程式为 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为 。
A.22.1 g B.27.2 g C.30 g D.无法确定
、现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。装置如图所示,根据上述情况,回答下列问题: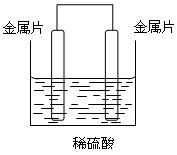
(1)四种金属的活动性顺序是_________________。
(2)在①中,金属片_____作负极;在②中,金属片_____上有气泡产生;在③中,金属片_____发生氧化反应。
(3)如果把B、D用导线连接后同时浸入稀硫酸中,则金属片_____上有气泡产生,该电极反应式为____________________。
(4)图示装置(金属片取①~③中的任一组)称为_________,它利用氧化还原反应将______能转化为______能。
(1)在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应的化学方程式为:______________________________________________________。
(2)往过氧化氢溶液中加入二氧化锰粉末可以产生氧气,此反应中二氧化锰的作用是_____________。
(3)在SO2、CaO、D2、HCl、Na2CO3五种纯物质中,属于共价化合物的是_________________________;含非极性键的是_______________。
(4)已知:2 SO2 + O2 2 SO3。向一密闭容器中充入SO2与18O2,反应一段时间后,含18O的物质是_______________________。
2 SO3。向一密闭容器中充入SO2与18O2,反应一段时间后,含18O的物质是_______________________。
(5)如下反应:
① Zn + CuSO4 = ZnSO4 +Cu② NaOH + HCl =" NaCl" + H2O
③ 4Al + 3O2 = 2Al2O3④ Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
其中可以设计成原电池的是_______________(写序号)。
25℃时,有0.01 mol•L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又发生变化? 电离常数是否发生变化? 为什么 ?
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。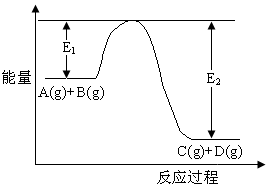
(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”“不变”),原因是______________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______________________________________________________;
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_______,E2_______(填“增大”“减小”“不变”)。
已知:
2Al (s)+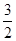 O2(g)===Al2O3(s)△H=" -1" 644.3 kJ• mol-1
O2(g)===Al2O3(s)△H=" -1" 644.3 kJ• mol-1
2Fe (s) +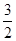 O2(g)===Fe2O3(s)△H=" -815.88" kJ• mol-1
O2(g)===Fe2O3(s)△H=" -815.88" kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式___________________________。