下列叙述正确的是
| A.1mol任何物质都含有6.02×1023个原子 |
| B.0.012kg12C含有6.02×1023个碳原子 |
| C.硫酸的摩尔质量是98g |
| D.常温常压下,1mol氧气的体积为22.4L |
水的电离平衡曲线如图所示,下列说法不正确的是
| A.图中五点KW间的关系B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |
氨水有下列平衡NH3·H2O NH4++OH-,当其他条件不变时,改变下列条件,平衡向左移,且c(NH4+)增大的是
NH4++OH-,当其他条件不变时,改变下列条件,平衡向左移,且c(NH4+)增大的是
| A.加NaOH | B.加盐酸 | C.加NH4Cl | D.加同浓度氨水 |
某次酸雨的分析数据如下:c(NH4+)=2.0×10-5 mol·L-1,c(Cl-)=6.0×10-5 mol·L-1,c(Na+)=1.9×10-5 mol·L-1,c(NO3—)=2.3×10-5 mol·L-1,c(SO42—)=2.8×10-5 mol·L-1,则此次酸雨的pH大约为
| A.3 | B.4 | C.5 | D.6 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于 p% | D.无法判断 |
高温下,某反应达到平衡,平衡常数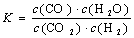 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |