已知:乙醛在一定条件下可被氧气氧化为乙酸。A是石油裂解主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物之间的转化关系:
(1)A的结构简式为 ,可以作为水果的 ;
(2)B+D→E的反应类型为 ;
(3)写出B→C和B+D→E的两个化学反应方程式:
B→C: ,
B+D→E: ;
(4)如何除去E中所混有少量的D杂质,简述操作过程: 。
侯氏制碱法制取纯碱的生产流程如图所示:
某小组同学在实验室模拟该流程制纯碱,设计如下:
可供选择的试剂有:6 mol·L-1盐酸、6 mol·L-1硫酸、浓氨水、生石灰、石灰石、氯化铵、蒸馏水和冰。(夹持仪器略)
请回答:
(1)A装置中所装试剂是和,B装置的作用是。
(2)用相关化学用语说明D装置制取气体的原理。
(3)检验D装置中产生的气体的方法。
(4)根据下表中四种物质的溶解度,回答:
①侯氏制碱是在30 0C左右进行生产的,那么沉淀池中在30 0C时析出的物质X是,分离方法。C装置中反应的化学方程式是。
②依据上表和工业流程图,为了从C装置中分离后的溶液中得到更多的副产品NH4Cl,可采取的措施是。
a.加NH3和NaCl b.通入CO2c.降低温度
(5)C装置中产品X经煅烧得到纯碱,其中常含有少量的NaCl,为测定其纯度,某实验小组设计的以下方案正确的是。
①取纯碱样品a g于试管中,溶解后,加入过量盐酸,用碱石灰吸收产生的气体,碱石灰增重b g。
②取纯碱样品a g于试管中,溶解后,先加入过量硝酸酸化,再滴加过量的AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g。
③取纯碱样品a g于试管中,溶解后,滴加过量的CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g。
研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
(2)SO2可用足量的NaOH溶液吸收,该反应的离子方程式为______;若继续通入SO2,当n (SO2): n(NaOH)=1:1时所得溶液呈酸性,下列关系正确的是_____ (填字母编号)。
a. c(Na+)> c(HSO3-)> c(SO32-)
b. c(Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
c. c(Na+)= c(SO32-)+ c(HSO3-)
SO2也可用O2氧化生成SO3
已知:①NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
②2NO(g)+O2(g)  2NO2(g)ΔH =" -113.0" kJ/mol ;
2NO2(g)ΔH =" -113.0" kJ/mol ;
则反应2SO2(g)+O2(g)  2SO3(g)ΔH=______ kJ/mol。
2SO3(g)ΔH=______ kJ/mol。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
①该反应ΔH______0(填“>”或“<”)。
②若容器容积不变,下列措施可提高CO转化率的是_____。
a.升高温度 b.将CH3OH(g)从体系中分离
c.充入氦气,使体系总压强增大 d.再充入一定量的 CO气体
H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第________周期第________族;C的基态原子核外有_________对成对电子;Cl原子的价电子表示式________.
(2)用“>”、“=”、“<”填空
| 稳定性 |
得电子能力 |
离子半径 |
电负性 |
| CH4____NH3 |
1H_____2H |
Na+_____Al3+ |
C____Al |
(3)用电子式表示NaCl的形成过程:__________________________________________.
(4)已知在常温常压下:
| 化学键 |
H—H |
H—Cl |
Cl—Cl |
| 键能kJ/mol |
a |
b |
c |
写出H2与Cl2反应的热化学方程式:_________________________________________.
[化学一选修3:物质结构与性质](15分)A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为;D和E的电负性大小关系为(用元素符号表示)。
(2)化合物E2D分子的空间构型为,中心原子采用杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为,任意写出一种它的等电子体的化学式为。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于晶体,晶体内含有的作用力类型有。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为g/cm3。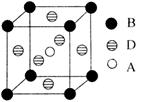
[化学一选修2:化学与技术](15分)随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: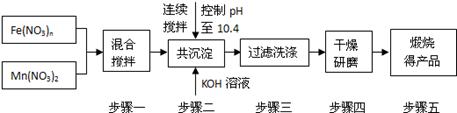
(1)原料Fe(NO3)n中n=,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为。
(2)步骤二中“连续搅拌”的目的是;步骤三中洗涤干净的标准是。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4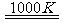 MnFe2O4-x+
MnFe2O4-x+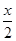 O2↑
O2↑
MnFe2O4+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为。
②该热化学循环法制氢的优点有(答两点即可) 。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是。