某化学反应中,反应混合物A、B、C的物质的量浓度(c )与时间(t)关系如下所表示:
| t/ c |
初始 |
2min |
4min |
6min |
8min |
| c(A)(mol/L) |
1.45 |
1.28 |
1.00 |
1.00 |
1.20 |
| c(B)(mol/L) |
0.38 |
0.72 |
1.28 |
1.28 |
0.88 |
| c(C)(mol/L) |
0.095 |
0.18 |
0.32 |
0.32 |
0.42 |
下列说法正确的是: ( )
A.该反应的化学方程式为A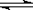 2B+C B.2 min末A的转化率为11.7%
2B+C B.2 min末A的转化率为11.7%
C.4--6min时,反应停止了
D.6--8min之间的变化是由于增加了A的浓度引起的
将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是( )
| A.b可能等于a、小于a或大于a |
| B.若a=b,则CO2与NaOH溶液反应生成的盐只有Na2CO3 |
| C.用上述数据不能确定NaOH溶液的物质的量浓度 |
| D.参加反应的CO2体积为0.224a L |
CO2与H2的混合气体5 g,在150 ℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4 g,则原混合气体中CO2的体积分数为( )
| A.25% | B.75% | C.88% | D.32% |
某中性的溶液中含有Na+、NH4+、Fe2+、Br-、CO32-、I-、SO32-七种离子中的某几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定存在的离子是( )
| A.NH4+、Br-、CO32- | B.Na+、Br-、CO32- |
| C.Na+、I-、SO32- | D.NH4+、CO32-、I- |
多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是( )
| A.2 | B.3 | C.4 | D.5 |
下列实验操作中仪器末端需插入液面下的有()
①用NaOH溶液和FeSO4溶液制Fe(OH)2时吸有NaOH的滴管;②制备H2的简易装置中的长颈漏斗;③分馏石油时控制温度所用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气时的导气管
| A.③⑤ | B.②⑤ | C.①②④ | D.①②③④⑤ |