(12分)近年来,我国科学家对有机物的“自由基”的研究有新的突破,在国际上占有领先的地位。有机物中常见的最简单的自由基是碳烯(:CH2),它十分活泼,很容易用它的两个未成对电子与不饱和烃反应,生成三碳环;也可以插在烷基的碳氢键(C—H)之间,使碳链增长。请回答下列问题:
(1)写出碳烯的电子式
(2)写出碳烯与丙烯反应产物的结构简式
(3)碳烯与烃A反应,生成烃B,一定量的B完全燃烧生成8.8g CO2和4.5g H2O,B分子中含有3个-CH3,且能完成下列转化关系: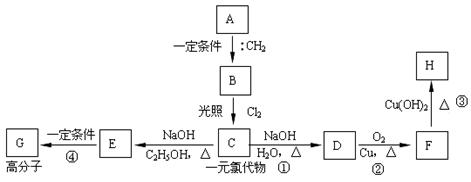
①写出A的结构简式 ,反应①的类型 ;
②写出反应③④的化学方程式: 反应③ ;
反应④ 。
③H的同分异构体有多种,请写出能与NaOH溶液反应,但不与NaHCO3溶液反应的同分异构体的结构简式 。
(8分)磷元素有多种化合价(-3、0、+1、+3、+5)。次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元弱酸,写出其电离方程式: _____________________
(2)H3PO2可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①H3PO2中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:
③写出H3PO2与足量氢氧化钠溶液反应的离子方程式:
(3)将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2 ,写出白磷与氢氧化钡溶液反应的化学方程式:
(8分)现有250C 101KPa条件下的氯化氢(HCl)气体49L(注:250C 101KPa条件下气体摩尔体积为24.5L/mol)则:
①该气体所含原子总数为______________。
②该气体的质量为_____________g。
③该气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为______________。
④取出20.0 mL该溶液,配成浓度为2.00 mol/L的稀溶液,则稀释后溶液的体积是______________ml
实验室里迅速制备少量氯气可利用以下反应:
KMnO4+HCl  KCl + MnCl2 +Cl2↑ + H2O
KCl + MnCl2 +Cl2↑ + H2O
(1)请配平上述化学方程式,并在上面用“双线桥” 标明电子转移的方向和数目:
(2)该反应的氧化产物是,KMnO4发生反应。
(3)用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为mol,转移电子数为。
(10分)现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液
⑥铜 ⑦熔融的KOH ⑧蔗糖,
其中属于电解质的是,属于非电解质的是
(1)写出FeCl3的电离方程式:__________________________________________,
(2)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:________________________,
(3)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入溶液,继续煮沸至,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做。
③区分胶体和溶液常用的方法叫做。
(本题共10分)
在 1.0L恒容密闭容器中放入0.10 mol A (g),在一定温度进行如下反应。
A(g)  2B(g) + C(g) + D(s) △H =+85.1 kJ / mol
2B(g) + C(g) + D(s) △H =+85.1 kJ / mol
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。
| 时间t/min |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
| P/P0 |
1.00 |
1.50 |
1.80 |
2.20 |
2.30 |
2.38 |
2.40 |
2.40 |
回答下列问题:
(1)该反应的平衡常数表达式K=。
(2)0~2 min内的平均反应速率v(B)=。
(3)下列能提高 A 的转化率的是。
A.升高温度 B.向体系中通入A气体
C.减少D的物质的量D.向体系中通入稀有气体He
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 D 的取值范围n (D)mol 。
(5)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时 B 的浓度为 。(保留三位有效数字)。