为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入Fe(NO3)3
溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较
强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧
化Cu”,并设计实验进行探究。
已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10 -7 -7 |
请回答:
(1)稀硝酸和Cu反应的化学方程式为 ( ) 。
(2)请利用所提供的试剂,帮助乙同学完成实验 方案设计。
方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸 方案: ( )
(3)丙同学分别实 施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH
施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH
的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①根据实验现象写出发生反应的离子方程式: ( 。)
②导致实验过程中溶液pH略有上升的可能原因是 ( )
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的: ( )
化学将对人类解决资源问题作出重大贡献。
乙基香草醛(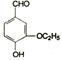 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)写出乙基香草醛分子中的含氧官能团的名称:醛基、;
(2)乙基香草醛不能发生下列反应中的(填序号);
①氧化②还原③加成④取代⑤消去⑥显色⑦加聚
(3)乙基香草醛有多种同分异构体,写出符合下列条件乙基香草醛所有同分异构体的结构简式;
①属于酯类②能与新制氢氧化铜加热后反应生成红色沉淀
③苯环上有两个处于对位的取代基,其中一个是羟基
(4)尼泊金乙酯是乙基香草醛的一种同分异构体,可通过以下过程进行合成: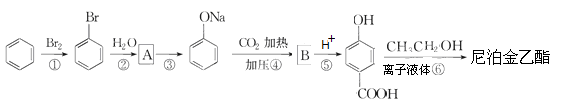
(a)写出A和B的结构简式:A,B;
(b)写出第⑥歩反应的化学方程式。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。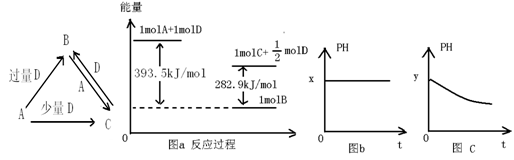
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为;
②反应B+A→C的离子方程式为;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为;
②若图c符合事实,则其pH变化的原因是(用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式:。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: 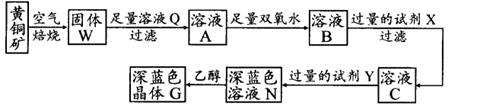
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: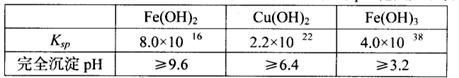
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式:;
(2)试剂X的化学式为;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为,用pH试纸测该溶液pH值的方法是;
(4)在溶液N中加入乙醇的目的是。
甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度(℃) |
|
| 500 |
800 |
||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+ CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。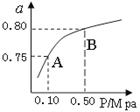
(3)判断反应③△H0; △S0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。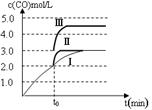
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(5)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为:。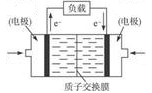
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为 。
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下: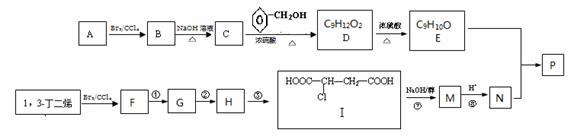
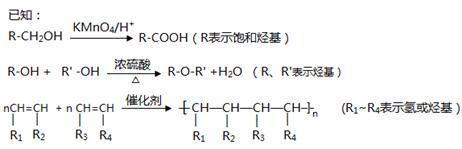
(1)A的结构式为________________ ,C的名称为
(2)D中含有的官能团的名称
(3)由F经①~③合成I,F可以使溴水褪色.反应①的化学方程式是。
反应②的反应类型是反应③的反应试剂是。
(4)下列说法正确的是。
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol I最多消耗3molNaOH
d.N不存在顺反异构体
(5)写出由D生成E的化学方程式。
(6)E与N等物质的量发生共聚反应生成P,则P的结构简式为。
(7)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式。
a.苯环上有两个取代基
b.能使FeCl3液显紫色
c.1mol该有机物与浓溴水反应时能消耗4molBr2