工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6 NOx (2x + 3)N2 + 6xH2O
(2x + 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
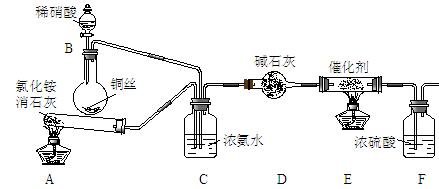
①装置A中发生反应的化学方程式为 ▲ 。
②装置D中碱石灰的作用是 ▲ 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:
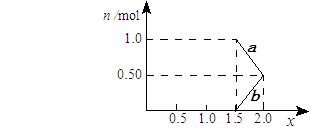
图中线段a表示 ▲ 离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲ g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L (标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为
(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为  ▲ 。
▲ 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲ 。
选考[化学——选修3:物质结构与性质] (13分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的价电子排布式,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有(填元素符号),上述方程式中涉及到的N、O、P、S元素第一电离能由小到大的顺序为。及电负性由小到大的顺序为。
(2)氨基乙酸铜的分子结构如图,氮原子的杂化方式为。
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为。
(4)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为。
(14分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:。装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入。
| a |
b |
c |
d |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:。
(5)如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气0.06 mol。(填“大于”“小于”“等于”),若有17.4 g的MnO2被还原,则被氧化的HCl的质量为。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _。
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
| 元素 |
A |
B |
C |
D |
E |
| 性质 或结 构信 息 |
室温下单质呈气态,原子最外层电子数与D相同 |
D3B中阳离子与阴离子的电子层结构相同 |
A和C可形成两种常见的化合物甲和乙,甲有强氧化性 |
单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 |
E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
试回答以下问题
(1)B在周期表中的位置是,B的氢化物与E的氢化物比较,沸点较高的是(填化学式)。
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式。
(3)写出丙的电子式为。说明丙在空气中漂白的原理(用化学方程式表示)。(请参考下表数据)
| 酸 |
电离常数 |
| HClO |
Ka=3.0×10-8 |
| H2CO3 |
Ka1=4.3×10-7,Ka2=5.6×10-11 |
(4)由B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成蓝色溶液,写出该反应的离子方程式。
(10分)某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
已知:Si+ 2NaOH +H2O= Na2SiO3 + 2H2↑,H2SiO3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(4)下列因操作不当,会使测定结果偏大的是___________
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |