取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为
| A.2:1:2 | B.6:3:2 | C.2:1:3 | D.3:7:1 |
下列反应的离子方程式正确的有
| A.碳酸氢钙溶液中加入足量的苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
B.电解饱和食盐水:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| C.氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O |
| D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
如下图所示,下列关于实验现象的描述正确的是
| a电极 |
B电极 |
X溶液 |
实验现象 |
|
| A |
石墨 |
石墨 |
CuCl2 |
a电极质量增加,b电极放出无色气体 |
| B |
Fe |
石墨 |
KNO3 |
a电极质量增加,b电极放出无色气体 |
| C |
Fe |
Cu |
CuSO4 |
a电极质量增加,b电极质量减少 |
| D |
石墨 |
石墨 |
HCl |
A电极放出无色气体,b电极放出无色气体 |
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 1
C.欲用(丙)装置给铜镀银,H极应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
KI + 3H2O  KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –+ 3H2O → IO3 – + 6H++ 6e – |
| C.溶液调节至强酸性,对生产有利 |
| D.电解后溶液的pH明显减小 |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下
发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指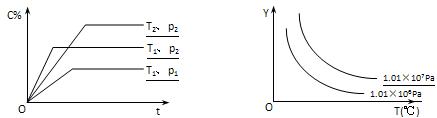
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量