几种短周期元素的原子半径及其某些化合价见下表:
| 元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
| 常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族。
(2)A、H、J对应离子的半径由大到小的顺序是(填离子符号)_______________________________。
(3)A与I所形成的化合物的晶体类型是 。
(4)DB2的电子式__________ 。
(5)D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式 。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。试依次写出Fe电极上可能发生的电极反应式:____________、___________(可不填满,也可补充)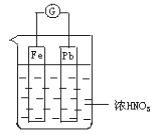
(1)如图所示装置,回答下列问题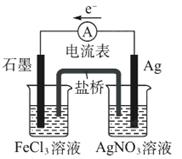
盐桥中阴离子移向溶液,正极电极反应式为,该装置中发生的总反应的离子方程式为。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2点燃2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是______(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为。
(8分)根据下边的实验装置图回答下列问题。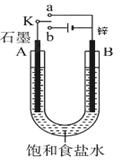
(1)若开始时开关K与a连接,则B极的电极反应式为;
(2)若开始时开关K与b连接,则B极的电极反应式为;
总反应的化学方程式为;
有关上述实验,下列说法正确的是(填序号)。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(8分,改编)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。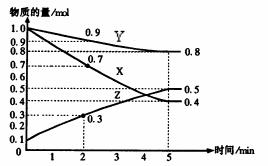
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至5min时Z的平均反应速率为 ;
(3)5min后,Z的生成速率比Z的消耗速率 (填“大”、“小”或“相等”),原因是
、