(1)在298K时,1molC2H 6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ。写出该反应的热化学方程式 。若C2H6和氧气以KOH溶液组成燃料电池,其负极反应式为 。
6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ。写出该反应的热化学方程式 。若C2H6和氧气以KOH溶液组成燃料电池,其负极反应式为 。
(2) A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水 ,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
①写出下列元素的符号A ,D 。
②用电子式表示B、F形成的化合物为 。
③A、C两种元素最高价氧化物的水化物之间 反应的离子方程式为
反应的离子方程式为  。
。
④ D的固态氧化物是 晶体。含nmolD的氧化物的晶体中含D—O共价键为 mol。
将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)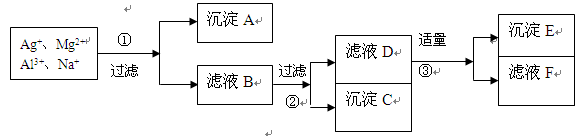
(1)沉淀A是 ___,沉淀C ___,沉淀E是;
(2)加入试剂①是 ____,②是________________,③是______________。
某种常见的白色晶体A,与盐酸反应产生无刺激性气味的气体B,将B通入澄清石灰水,石灰水变浑浊。若在A的水溶液中加氢氧化钡溶液微热,则析出白色沉淀C和无色气体D,D可以使湿润的红色石蕊试纸变蓝。加热固体A,可生成水、B和D,而且B和D的物质的量之比为1:1.根据以上事实,可以判断出A是,B是,C是。
加热固体A生成水、B和D的化学方程式是_____________,
A与盐酸反应的离子方程式___________________________________,
A与氢氧化钡溶液反应的离子方程式_______________________________________________。
如右图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由_______________逐渐变为_______色,试管内的液面会逐渐_____________,剩余气体约占试管容积的__________,用化学方程式表示这种变化__________________________;上述反应停止后向试管中缓慢通入氧气,气体颜色又由______色逐渐变为____________色,之后又变为______色,继续通入氧气,直到试管中充满液体为止,用一个化学方程式表示试管中发生的化学反应_____________________________________。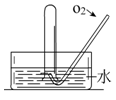
我国使用最早的合金是_____________,目前用量最大,使用最广泛的合金是___________。合金的硬度一般比它的各成分金属的硬度_________,多数合金的熔点一般比它的各成分金属的熔点___________。镁铝合金投入氢氧化钠溶液中,反应的化学方程式为__________________________,红热的铁片投入水中,表面生成一层黑色晶体,反应的化学方程式为___________________________。
(1)写出电解食盐水的化学方程式:;
写出实验室制取氯气的化学方程式:。
(2)鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含Fe2+,现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。这个变色的过程中的Fe2+被(填“氧化”或“还原”)。若榨汁时加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有性。
(3)为防止碘缺乏病,通常在食盐中添加少量碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应。用双线桥标出方程式中电子转移的方向与数目。
5 KI+ KIO3+ 3H2SO4="" 3 I2+ 3 K2SO4+ 3 H2O
此反应中氧化剂和还原剂的物质的量之比是。