将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)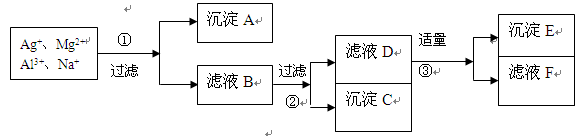
(1)沉淀A是 ___,沉淀C ___,沉淀E是 ;
(2)加入试剂①是 ____,②是________________,③是______________。
(1)粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质。在提纯时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是___________。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
(2)己知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,㏒2=0.3。通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全。试计算
①将溶液的pH调至PH=__________时Fe3+转化为Fe(OH)3而沉淀完全。
②若CuSO4溶液的浓度为2.2mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__________。
(3)调整溶液的pH可选用下列中的____________。
A.NaOH(aq) B.NH3·H2O C.CuO粉末 D.Cu(OH)2悬浊液 E.Cu2(OH)2CO3(s)
20℃时,醋酸的电离平衡常数为1.6×10-5。
(1)试计算20℃时0.01mol•L-1的醋酸溶液中氢离子浓度。
(2)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的PH=4,则:
①所得溶液中各离子(包括CH3COOH分子)浓度大小关系是:______________________,
②所得溶液中的物料守恒式为:________+________=__________=_________mol•L-1。
③c(CH3COOH)=_____________mol•L-1(写出算式,不做近似计算)
将镁铝的混合物0.1mol溶于100ml 2mol/L硫酸溶液中,然后再滴加1mol/L的NaOH溶液,请回答:
(1)若在滴加NaOH溶液过程中,沉淀质量随加入NaOH溶液的体积变化如图所示,当V1=160mL时,则金属粉末中n(Mg)=mol, V2=mL,
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积 V(NaOH) =mL
V(NaOH) =mL
(3)图像中A点的意义是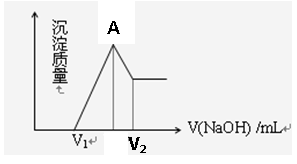
已知在含HNO3的溶液中放入Al不生成H2。某无色透明溶液跟金属铝反应放出H2。试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO32-、SO42-、HCO3-、OH-、NO3-,在下列两种情况下何者能存在于溶液中。
(1)当生成Al3+时,可能大量存在_________________________________________________。
(2)当生成 时,可能大量存在_______________________________________________。
时,可能大量存在_______________________________________________。
取两等份铝粉,第一份加入250 mL 2 mol·L-1的盐酸,第二份加入400 mL2mol·L-1的烧碱。若同温同压下放出气体体积之比为5:6,则加入的铝粉每份质量为。