在常温常压下,已知:4Fe(s) + 3O2(g) = 2Fe2O3(s) ΔH1
4Al(s) + 3O2(g) = 2Al2O3(s) ΔH2
2Al(s) + Fe2O3(s) = Al2O3(s) + 2Fe(s) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=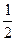 (ΔH1+ΔH2) (ΔH1+ΔH2) |
B.ΔH3=ΔH2-ΔH1 |
| C.ΔH3=2(ΔH2+ΔH1) | D.ΔH3=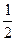 (ΔH2-ΔH1) (ΔH2-ΔH1) |
用食用白醋(醋酸浓度约1mol/L)常温下进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 |
| B.实验测得该白醋的pH为2.3 |
| C.蛋壳浸泡在白醋中有气体放出 |
| D.白醋加入豆浆中有沉淀产生 |
下列电离方程式正确的是
A.H2S  2H++ S2- 2H++ S2- |
B.HF = H++ F- |
| C.NaHSO3 = Na++ H++SO32- | D.H2CO3+ H2O H3O+ + HCO3- H3O+ + HCO3- |
常温下,体积相同,pH相同的盐酸和醋酸两种溶液中,下列两者的量相同的是
| A.电离程度 |
| B.酸的物质的量浓度 |
| C.与Zn反应开始时的反应速率 |
| D.与足量的Zn反应产生H2量 |
醋酸溶液中存在电离平衡:CH3COOH  CH3COO- + H+ 下列叙述不正确的是
CH3COO- + H+ 下列叙述不正确的是
A.CH3COOH溶液中离子浓度的关系满足: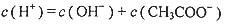 |
B.0.1 mol / L 的CH3COOH 溶液加水稀释,溶液中c(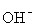 )减小 )减小 |
| C.CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后,溶液的pH<7 |
0.1 mol / L的醋酸溶液中存在电离平衡:CH3COOH  CH3COO-+H+,若溶液温度从室温升高到60℃,则溶液
CH3COO-+H+,若溶液温度从室温升高到60℃,则溶液
| A.pH增大 | B.c(CH3COOH)增大 |
| C.CH3COOH电离程度增大 | D.c(H+)×c(OH-)=1×10-14 |