2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
用规范的化学语言回答下列问题:
(1)过氧化钠跟CO2反应的化学方程式。
(2)一定条件下,乙醛可跟氢气反应生成乙醇,该反应的反应类型是。
(3)氯化铵溶液呈酸性的原因(用离子方程式回答)。
(4)氢氧化镁浊液中的溶解沉淀平衡方程式。
(5)氯碱工业中用电解饱和食盐水的方法制取烧碱和氯气,该电解过程中的电极反应方程式为:阳极,阴极。
稀盐酸与铝发生反应,要生成3.36L氢气(标准状况),需消耗铝g;反应过程中转移mol电子。
电浮选凝聚法是工业上采用的一种污水处理方法下图是电解污水装置示意图。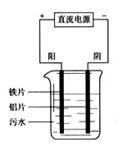
(1)根据污水净化原理写出阳极和阴极的电极反应:
阳极:_____________________,_________________,____________________。
阴极:______________________________。
(2)分析最后底层积聚的一层沉渣是如何沉淀的:__________________________________ __。
(3)一些悬浮物是怎样形成浮渣的:___________________________________________________。
测定铜合金中铜的含量,可以用稀硝酸来溶解样品,也可以用双氧水和稀盐酸溶解样品,其反应的化学方程式为: 。假设样品中其他成分不与稀硝酸、双氧水和盐酸反应。
。假设样品中其他成分不与稀硝酸、双氧水和盐酸反应。
①写出铜与稀硝酸反应的离子方程式并标出电子转移的方向和数目____________________。
②在铜与双氧水、盐酸的反应中氧化剂是______________________________,若有2 mol的H2O2参加反应,则电子转移的物质的量是_______________。
③用双氧水和稀盐酸溶解样品与用稀硝酸溶解样品相比较,哪种更好?为什么?____________________。
④若称取样品的质量为a g,用足量的双氧水溶解后,剩余残渣经过洗涤干燥称得质量是b g,
则样品中含铜的质量分数为__________。
实验室通常用二氧化锰和浓盐酸反应制取氯气写出反应方程式______________,浓盐酸还可以和氯酸钾发生反应制取氯气写出反应方程式______________,氯气具有较强的__________性。