(8分)下图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量1mol的NO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L。已知:2NO2(g) 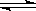 N2O4(g)
N2O4(g) 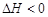
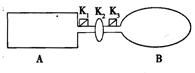
(1)B中可通过 判断可逆反应2NO2(g) 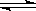 N2O4(g)已经达到平衡。
N2O4(g)已经达到平衡。
(2)若平衡后向A中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数 (填“变小”、“变大”或“不变”)。
(3)若A中到达平衡所需时间为t s,达到平衡后容器内压强为起始压强的0.8倍,则平均反应速率v(NO2)= 。
(4)若打开K2,平衡后B的体积缩至0.4a L,则打开K2前,B的体积为 。
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| 族 周期 |
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 3 |
11 Na 钠 22.99 |
12Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:_____________________。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(3)第11号元素与第17号元素组成的化合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)下图A、B、C是三种粒子的结构示意图.试回答下列问题: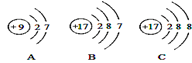
①A、B、C中属于同种元素的粒子是 ;
②A和B两种粒子的 相同,所以它们具有相似的化学性质;
分)(用化学符号填空:
(1)①氯化亚铁中的阳离子 ;②标出碳酸钡中钡元素的化合价 ;③三个钙原子________。
(2)①SO3中“3”的含义: ;②Mg2+中“2”的含义: 。
(3)“候氏制碱法”中的创始人 。
如图所示的是初中化学中的一些重要实验。请回答下列问题: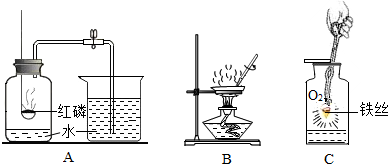
(1)实验A:测得空气中氧气体积分数小于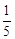 的原因可能是(只答一条): 。
的原因可能是(只答一条): 。
(2)实验B:用玻璃棒搅拌的目的是 。
(3)实验C:集气瓶内放少量水的目的是 。
在具有活塞的密闭容器中,一定温度下的可逆反应,H2(g)+I2(g)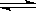 2HI(g)已达平衡,将活塞外拉,在此过程中:
2HI(g)已达平衡,将活塞外拉,在此过程中:
(1)容器颜色 (填“变浅”或“变深”)
(2)容器内的压强 (填“变大”“变小”或“不变”)
(3)混合气体的密度 (填“变大”“变小”或“不变”
某密闭容器中,有A、B两种气体,反应按下式进行A(g)+B(g)=2C(g)反应经过2s后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75 mol/L,c(C)=0.5 mol/L。
(1)B物质的起始浓度各为
(2)2s时A的转化率
(3)用物质A表示反应的平均速率