已知A是乙烯,B、C、D、E均为常见的有机物,在一定条件下,它们有如下力
所示的转化关系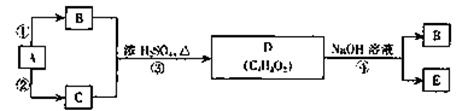
请回答:
(1)C的结构简式是
(2)能与金属钠反应放出氢气的物质有 (填字母)
(3)在图示转化关系中,属于加成反应的有 (填序号)
(4)A、B、C三种物质的摩尔质量由大到小的顺序是
(5)反应④的化学方程式是
按要求回答下列问题:
(1) 的系统命名为;
的系统命名为;
(2)3甲基2戊烯的结构简式为;
(3) 的分子式为;
的分子式为;
(4)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体。
①试写出它的一种链式结构的同分异构体的结构简式_______________________。
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为________________________形。
实验室制欲用固体NaOH来配0.5mol/L的NaOH溶液500mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_________。
(4)在配制过程中,若其它操作均正确,下列操作会引起结果偏高的是
| A.没有洗涤烧杯和玻璃棒 |
| B.未等NaOH溶液冷却至室温就转移到容量瓶中 |
| C.容量瓶不干燥,含有少量蒸馏水 |
| D.定容时俯视标线 |
E、称量时间过长
阅读、分析下列两个材料:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| 乙二醇 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇 |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
根据上述材料,回答下列问题____(填写序号):
A、蒸馏法B、萃取法
C、“溶解、结晶、过滤”的方法 D、分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用_______。
(2)将乙二醇和丙三醇相互分离的最佳方法是__________。
(3)用CCl4提取溴水中的溴单质的最佳方法是_________.
(4)分离汽油和水的最佳方法是___________
在Cu+4HNO3 = Cu(NO3)2 + 2NO2↑+2H2O反应中,________是氧化剂;______氧化产物;当6.4gCu参加反应时,电子转移的总数为______mol。
在Fe、Fe3+、Fe2+几种微粒中,只有氧化性的是,只有还原性的是,既有氧化性又有还原性的是。向黄色的FeCl3溶液中加入 铁粉,溶液颜色变为浅绿色,写出该反应的离子方程式