硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率
,则N2的转化率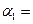 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则
 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
(10分)Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S=Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质.
为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀H2SO4溶液20mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
| 第一份 |
第二份 |
第三份 |
|
| 样品的质量/g |
12.60 |
18.90 |
28.00 |
| 二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
| 硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与稀硫酸可能发生反应的离子方程式为__________________________________;
_____________________________________________。
(2)根据上表数据分析,该样品_________________________(填选项字母);
A.含有Na2S2O3·5H2O和Na2SO4两种成分
B.含有Na2S2O3·5H2O和Na2SO3两种成分
C.含有Na2S2O3·5H2O、Na2SO3和Na2SO4三种成分
(3)该样品中各成分的物质的量之比为___________________________;
(4)所加硫酸溶液的物质的量浓度为___________________________mol/L。
将10g铁粉置于40mL较浓的硝酸中,微热完全反应时,收集到NO2和NO混合气体1792mL(标准状况下),还残留4.4g固体。求:
(1)该反应中被还原的硝酸和未被还原的硝酸的物质的量之比;
(2)原硝酸的物质的量浓度;
(3)NO和NO2的体积比;
(4)写出总的化学方程式。
在100mL 0.5mol/L AlCl3溶液中加入100mL NaOH溶液,得到0.78g Al(OH)3沉淀,则NaOH的物质的量浓度可能为多少?
在5 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g)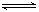 2C(g),10min后达平衡时,在相同温度
2C(g),10min后达平衡时,在相同温度 下测得容器内混合气体的物质的量是反应前的5/6,试计算
下测得容器内混合气体的物质的量是反应前的5/6,试计算
①A的转化率
②平衡常数K
③10min内生成物C的反应速率
在标准状况下,有二氧化碳与一氧化碳的混合气体共6.72L,其质量为10.8 g。求:混合气体中二氧化碳与一氧化碳的质量和体积各为多少?