为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答: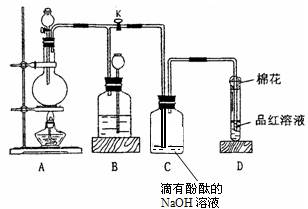
(1)装置A中发生的化学反应方程式为_____________________________________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_____________,其作用是(用离子方程式表示)_________________________ 。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。
B中应放置的液体是(填字母)__________________。
a.水 b.酸性KMnO4溶液 c.NaOH溶液 d.饱和NaHSO3溶液
(4)装置C和D中产生的现象相同,但原因却不同。C中是由于 ,而D中则是由于 。
(5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
欲用无水CuSO4粉末配 制500mL 0.1mol·L—1CuSO4溶液。根据题意填空:
制500mL 0.1mol·L—1CuSO4溶液。根据题意填空:
(1)如图所示仪器,配制上述溶液肯定不需用到的是(填字母)配制上述溶液还需要的玻璃仪器有 (填仪器名称)。
(填仪器名称)。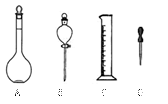
(2)配制该溶液应选用mL容量瓶,使用容量瓶之前必须进行。
(3)配制该溶液 应用托盘天
应用托盘天 平称
平称 取g无水CuSO4。
取g无水CuSO4。
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度
偏低的是(填编号)。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(15分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。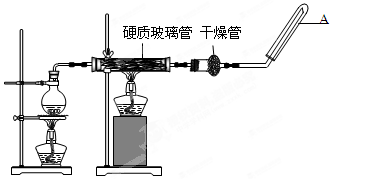
(1)写出该反应的反应方程式 ;
; 并指明该氧化还原反应的还原剂是,氧化剂是。
并指明该氧化还原反应的还原剂是,氧化剂是。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。
某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3=" 2NaI" + Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用____________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液40.00 mL,则废水中Cl2的物质的量浓度为__________________________。
(4)以上实验步骤中有一处明显的操作错误,请指出.
某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0mL于锥形瓶,加入10.0mLKI溶液(足量),滴入指示剂2—3滴
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01mol/L的Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6
请回答下列问题:
(1)步骤①加入的指示剂是
(2)步骤②应使用式滴定管
(3)步骤③当待测液由色变为色且半分钟不变化即达终点,若耗去Na2S2O3溶液20.0mL,则废水中Cl2的物质的量浓度为
(4)从实验操作步骤上看,氯气的实际浓度比所测浓度(填“偏大”、“偏小”或“相等”)
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去)。图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15 m L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
L 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。
(1)③试管中制取次氯酸钠的化学方程式为
(2)实验中可观察到④试管中溶液的颜色发生如下变化,填写表格。
| 实验现象 |
原因 |
| 溶液最初从紫色变为 色 |
氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 |
|
| 最后溶液从无色逐渐变为色 |
(3)此实验有一个明显的不足之处,应如何改进? 