实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作②是否可改为加硝酸钡溶液?为什么?
, 。
(2)进行操作②后,如何判断SO42-已除尽,方法是_______
__ ;
(3)操作③的目的是_ ;
(4)操作④的目的是________ _________________________。
(16分)某研究小组取足量形状、质量均相同的铝片,分别与浓度均为6 mol•L-1的等体积的盐酸、氢氧化钠溶液充分反应后,取出剩余的铝片洗净、干燥、称量。
(1)上述反应剩余铝片的质量,前者________后者(填“大于”或“小于”或“等于”)。
(2)观察铝片与盐酸反应后的溶液较浑浊,且试管底部有少量黑色固体。
查资料已知:
①铝与盐酸反应,因反应过快而变成粉末分散到溶液中,形成黑色固体
②电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,氧化铝中往往还含有微量的氧化铁和二氧化硅杂质。写出在电解池中生成的铝与杂质二氧化硅反应的化学方程式: ________。
(3)为探究(2)中黑色固体的成分,提出合理假设。
假设1:黑色固体是Al和Fe
假设2:黑色固体是Al和Si
假设3:黑色固体是Al和_______________
(4)设计实验方案,基于假设3进行实验,验证黑色固体含有Al之外的其它成分。
限选实验试剂:蒸馏水、6mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、6mol·L-1氨水、0.01mol·L-1KMnO4溶液、新制氯水、20%KSCN溶液。
| 实验步骤 |
预期实验现象和结论 |
| 步骤1:将反应所得浊液过滤、洗涤,取少量固体于试管中,加入足量的6mol·L-1 H2SO4溶液,充分振荡,静置。 |
___________________________________, 证明黑色固体含有Si |
| 步骤2: |
(5)已知硅与NaOH溶液反应与铝相似。取m1g黑色固体加足量NaOH溶液充分溶解,滤去不溶物(不考虑可溶物的损失),配成250mL溶液,取出25.00mL溶液,按下列操作进行实验: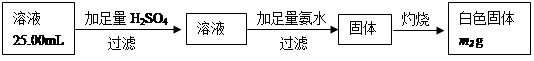
在上述操作中,需要用到的玻璃定量仪器有________________________________;
计算黑色固体中Al的质量分数为__________________(相对原子质量:Al-27 Fe-56 H-1 O-16)。
蛋壳的主要成分是CaCO3,其次是SiO2、MgCO3及色素等杂质,测定蛋壳中钙的含量时常涉及如图操作步骤,其中最后滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。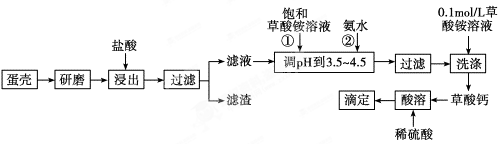
资料支持:①草酸的电离方程式为H2C2O4 H++HC2O4-;
H++HC2O4-;
②滴定过程的反应为H2C2O4+MnO2+H+―→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.5×10-9,Ksp(MgC2O4)=8.6×10-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________;
(3)实验中通常用0.1 mol/草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为________;
(4)达到滴定终点的特征为________________;
(5)若考虑MgCO3的存在,则此法求得的钙含量略__________实际值(填>、=、<)
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用_______式滴定管盛装c mol/L盐酸标准液。下图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积__________mL。 
②下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0—8.0 |
3.1—4.4 |
4.4—6.2 |
8.2—10.0 |
该实验应选用________作指示剂;
③有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
V |
0.50 |
25.80 |
25.30 |
| 2 |
 V V |
|||
| 3 |
V |
6.00 |
31.35 |
25.35 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
c = ______________________________。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
A.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________;
B.读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________;
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
D.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果__________。
某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。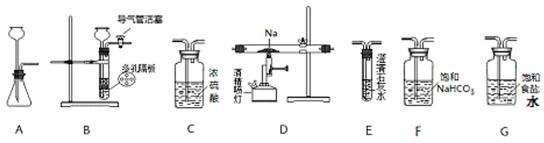
请回答下列问题:
(1)选择必要的仪器,按___________________________顺序连接好装置(填装置序号)。
(2)检验装置B气密性的方法:__________________________________。
(3)实验时,在点燃酒精喷灯前必须进行的操作是______________________,待装置E中出现_____________现象时,再点燃酒精喷灯,以上操作的目的是___________________。
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。两种产物中有一种是重要的化工原料,在玻璃工业中用量很大。则钠与二氧化碳反应的化学方程式是______________。
(5)上述实验生成的黑色物质与浓硫酸在一定条件下反应会生成一种大气污染物,可利用酸性KMnO4溶液来测定该气体在空气中的含量,反应的离子方程式__________________;判定反应是否需要指示剂(如果需要,选择何种指示剂,请描述现象。如果不需要,请说明理由。)___________________________________________。
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,用KMnO4、KClO3氧化浓盐酸可快速制取氯气.根据上述反应原理,有人提出能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢.某课外小组在实验室进行了探索性实验,设计了如图装置: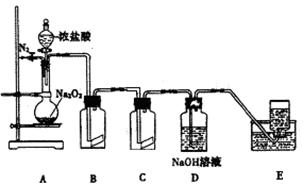
操作步骤及现在如下:
①组装好装置,检查装置的气密性,加入药品.
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
(1)写出KClO3氧化浓盐酸制取Cl2的离子方程式
(2)装置B中湿润的红色布条褪色,说明A中有 (填化学式)生成,装置C中为湿润的KI-淀粉试纸,能否仅通过试纸变蓝证明上述结论,请用离子方程式说明原因
(3)装置D的作用是
(4)写出生成O2的可能的反应方程式
(5)实验证明,Na2O2甚至能与干燥的HCl反应生成氯气,写出反应的化学方程式
综合上述实验,请分析实验室(填”能”或”否”)利用Na2O2与浓盐酸反应制备纯净的Cl2,理由是