已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCl3,其溶液在加热蒸于并灼烧时可发生如下反应:
a.甲+H2O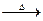 乙十丙 b.乙
乙十丙 b.乙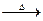 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金 属在周期表中的位置是: 。
属在周期表中的位置是: 。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:____。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
(2)若甲、乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲十乙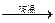 丙。则:
丙。则:
①甲的结构式为 。
②写出上述反应的化学方程式 。
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式 。
新合成的一种烃,其碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式。
(2)该烃的一氯取代物是否有同分异构体。
(3)该烃的二氯取代物有多少种。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或溴水溶液褪色,但在一定条件下能跟溴发生取代反应、与H2发生加成反应,这种同分异构体的结构简式是。
已知乙烯能发生以下转化: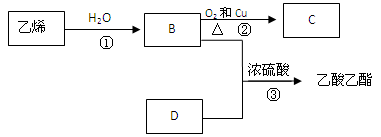
(1)乙烯的结构简式为: 、空间构型为___________.
(2)写出B、D化合物中官能团:B中含官能团;D中含官能团;
(3)写出反应的化学方程式
①反应类型:
②反应类型:
Ⅰ、已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是:。
Ⅱ、在铜片、锌片和400 mL稀硫酸组成的原电池中,若电路中通过0.2 mol电子,H2SO4恰好反应完毕。试计算:
(1)生成气体的体积(在标准状况下);
(2)原400 mL稀硫酸的物质的量浓度(不考虑溶液的体积变化)。
氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O 2H2↑+O2↑。制得的氢气可用于燃料电池。
2H2↑+O2↑。制得的氢气可用于燃料电池。
试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的______极;电子从该极________(填“流入”或“流出”)。
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是______,正极上发生反应的电极反应式为。
某研究性学习小组为探究纯铁与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验: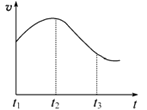
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是。
(2)若要加快化学反应速率,除实验②的方法外,还可以采取哪些措施?(至少写两点)
、
(3)某同学认为实验②反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验②中原电池的正、负极电极反应式。
(4)已知热化学方程式Fe(S) + 2H+ (aq) = Fe2+(aq) + H2(g)↑ ; △H= —42kJ/mol,28g的铁完全反应后放出的热量为。