某工厂对制革工业污泥中 Cr(Ⅲ)回收与再利用工艺如下(硝酸浸取液中金属离子主要是 Cr3+,其次是Fe3+、Ca2+、Mg2+)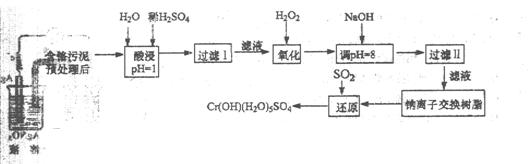
| 氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| pH |
3.7 |
11.1 |
8 |
9(>9溶液) |
部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见上表。
(1)酸浸时,为了提高浸取率可采取的措施 (至少写一条)。
(2)调pH=8是为了除去 离子(选填:Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为:Ma++nNaR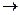 MRa+nNa+,被交换的杂质离子是 (选填:Fe3+、Al3+、Ca2+、Mg2+)。
MRa+nNa+,被交换的杂质离子是 (选填:Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平还原反应方程式: Na2Cr2O7+ SO2+ H2O= Cr(OH)(H2O)5SO4+
Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为  。
。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: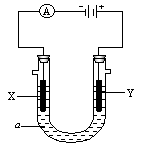
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是。在X极附近观察到的现象是。
②Y电极上的电极反应式是
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的电极反应式是
②Y电极的反应式是
(说明:杂质发生的电极反应不必写出)
(1)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(2)下列说法不正确的是__________。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的; |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
E. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是___________________,且各离子的物质的量之比为___________________;肯定不含的阳离子是____________________。写出平行线段线所发生反应的离子方程式:
保持洁净安全的生存环境已成为全人类的共识。
①下列措施不利于改善环境质量的是___________(填字母)。
| A.在燃煤中添加石灰石粉末以减少酸雨的发生 |
| B.为实现“低碳世博”,上海世博会很多展馆采用光电转化装置 |
| C.对所有垃圾通过露天焚烧或深埋的方式进行处理 |
| D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯 |
②对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为。
③居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是。
④获得洁净安全的饮用水是每个人的正常需要。
对饮用水常使用漂白粉或漂白精片进行杀菌消毒,漂白粉的有效成分为。写出过氧化钠和水反应的方程式。
材料与社会生活密不可分。
①在下列材料中,属于无机非金属材料的是_______(填字母)。
A.硬币 B.聚氯乙烯塑料 C.氮化硅陶瓷
②钢铁的生产与使用是人类文明和生活进步的一个重要标志。
工业炼铁原理的主要化学反应方程式为。
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:铁锅的腐蚀主要是由腐蚀造成的。为防止轮船的船体在海水中被腐蚀,一般在船身连接(填“锌块”或“铜块”)。