某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是 。
(2)燃烧的本质是 。
(3)2010年8月初发生的俄罗斯森林大火有比伦敦市还要大的面积。控制森林火灾是世界性难题。根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延? 。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计实验方案.验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na3O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(4)甲同学认为方案1得到的结论不正确,其理由是 。
(5)乙同学认为方案2得到的结论正确,白色物质为 。
(6)通过方案1和方案2的实验,你认为上述三个假设中, 成立。你的理由是 。
(7)钠在二氧化碳中燃烧的化学方程式为 。
(8)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由: 。
某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理并说明理由 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:3 mol·L-1H2SO4、3% H2O2、6 mol·L-1HNO3、0.01 mol·L-1KMnO4、NaOH稀溶液、0.1 mol·L-1Kl、20% KSCN、蒸馏水。
提出合理假设
假设1: ;
假设2: ;
假设3: 。
设计实验方案证明你的假设(不要在答题卡上作答)
实验过程
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| … |
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)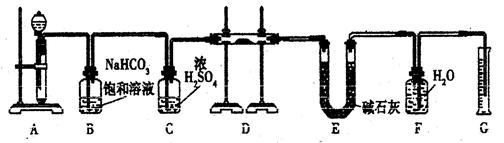
回答下列问题:
(1)装置A中液体试剂选用,理由是。
(2)装置B的作用是。
装置C的作用是。
装置E中碱石灰的作用是。
(3)装置D中发生反应的化学方程式是。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为。
实验室配制500ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是。
| A.加水定容时超过刻度线,又吸出少量水至刻度线; | B.忘记将洗涤液转入容量瓶; |
| C.容量瓶洗涤后内壁有水珠而未作干燥处理; | |
| D.称量碳酸钠粉末时左盘放砝码,右盘放药品; |
E、定容时俯视刻度线。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式
(2)实验前必须对整套装置进行的操作是
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是
(4)干燥管中盛装的物质可以是,作用是
(5)试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是
(8分)用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为mL。
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有3 0mL水的100mL的容量瓶中,加水至刻度线
0mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀