(1)甲烷是一重要的清洁能源、请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式: 。
(2)电解原理在化学工业中有广泛的应用。图中a为电解液,X和Y是两块电极板,则:
①若X和Y分别为铁和石墨,a为饱和食盐水,则电解时X电极反应式为 。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
(3)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如下图。
①结合右图分析,相同温度下Kap[Cu(OH)2]、Kap[Ni(OH)2]、Kap[Fe(OH)2]由大到小的顺序为 。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+、Fe2+和Ni2+沉淀的先后顺序依次为 (填写离子符号)。
食品、药品安全关系国计民生,国务院非常重视食品、药品安全,重庆也在严厉打击食品、药品犯罪。香精( )在食品、药品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。己知:A具有两种一氯代物B和C
)在食品、药品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。己知:A具有两种一氯代物B和C
回答下列问题:
(1)分别写出①和⑨的反应类型:①_________,⑨_________
(2)分别写出B和F的结构简式:B____________,F___________
(3)分别写出反⑤和⑦的化学方程式:
⑤_________________________________________________________________
⑦_________________________________________________________________
(4)写出符合以下条件并与 互为同分异构体的结构简式
互为同分异构体的结构简式
________________________________________________________________________________
①苯环上只有一个取代基,②能发生水解反应,③能发生银镜反应,④含有一个甲基。
过氧化氢(H2O2)有广泛的用途,过氧化氢的沸点为150℃。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
(NH4)S2O8+H2↑,(NH4)2S2O8+2H2O=2NH4HSO4+H2O2。其流程如下:
请回答下列问题:
(NH4)2S2O8中硫元素的化合价为_______。
(2)过氧化氢具有的化学性质是______。(填字母)。
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
(3)根据以上反应原理可知,电解硫酸氢铵溶液时,阳极的电极反应方程式是:
_______________________________________
(4)在上面流程图中,采用减压蒸馏的原因是:____________________________.
可循环利用的物质是_____________。
(5)硫酸铜酸性溶液中混有少量硫酸亚铁,为除去杂质,用过氧化氢把硫酸亚铁氧化,反应的离子方程式是________________________________________________________。
若X、Y两种元素在周期表中位于同一主族,其中一种为短周期元素,且两者相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):
Xm + Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX+ Yn + H2O → KXO3 + Xm+ HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX+ Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下: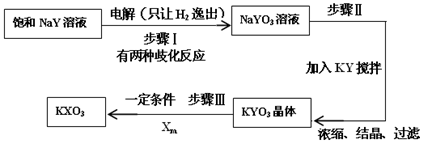
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中由NaYO歧化生成NaYO3的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。在2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
A~G均为有机化合物,它们之间的转化如下图所示:
已知以下信息:
a.A是以淀粉为原料生产的一种常见有机物; b. G是六元环酯;
c. E能发生银镜反应,且1molE能与4molAg(NH3)2OH反应。
请回答下列问题:
(1)C的系统命名为;D的官能团是。F的分子式为;
(2)②④⑤的反应类型分别是②,④⑤;
(3)写出指定过程的化学反应方程式:
C→D:;
D+F→G:。
(4)写出满足下列条件物质的结构简式
①是B的同系物;②在其同系物中含碳原子数最少;③具有顺反异构现象
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为_ ___其中心离子是,配位数为。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是和。
②T元素最可能是区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为,其中心原子的杂化方式为。