聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
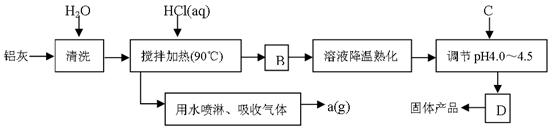
|
(1)搅拌加热操作过程中发生反应的离子方程式为: ;
。
(2)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用 。
| A.NaOH | B.Al | C.氨水 | D.Al2O3 E.NaAlO2 |
(共18分)
(1)在同温同压下,等质量的CO和CO2,其体积之比为 ,电子数之比为 ,密度之比为 。
(2)9.5gMgCl2固体溶于水配成500mL溶液,其浓度为 mol·L-1,从中取出100mL溶液,其中Cl-的浓度为 mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为 mol·L-1。
(3)某金属氯化物MCl2 27g ,含有0.40molCl-,则该氯化物的物质的量为_ _____,摩尔质量为 ,金属M的相对原子质量为 。
(共13分)
(1)混合物分离的方法在生产、生活和科学实验中有着广泛的应用。请指出下列做法中分别应用了哪些分离方法?
| A.分液 | B.过滤 |
| C.萃取 | D.蒸馏 |
E、蒸发结晶 F、加热分解
①除去Ca(OH)2溶液中悬浮的 CaCO3 ;②从碘水中提取碘 ;
③用自来水制取蒸馏水 ;④分离植物油和水 ;
⑤海水淡化 ;⑥除去 KCl 中少量 KClO3 ;
⑦熬煮中药 ;⑧用海水晒盐 。
(2)某同学要配制100mL 1mol·L-1NaCl溶液,配制时需选用的仪器主要有
, , , , 和试剂瓶。
【化学——选修3:物质结构与性质】
(1)按已知的原子结构规律,27号元素在周期表中的位置是 ,其价电子的轨道排布图为 。
(2)若en代表乙二胺(  ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①  ②
② 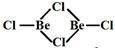
③ 
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离 。
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将SO2转化为重要化工原料C
若A为SO2,B为O2,则负极的电极反应式为:________________________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
① 0~6 min内,反应的平均速率v(Cl2)= ;
② 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③ 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④ 随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)______________T(15)(填“<”、“>”或“=”)。
发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g)△H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g)△H=-242kJ/mol
(1)气态肼和二氧化氮反应的热化学方程式为:_________________。
(2)有人认为若用氟气代替作氧化剂,则反应释放的能量更大,气态肼和氟气反应的热化学方程式为:__________________。