(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)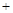 2H2(g)
2H2(g)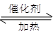 CH3OH(g)
CH3OH(g)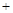 Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(1)判断反应达到平衡状态的依据是( )
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q 0 (填“>”、“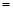 ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是( )
A.加入催化剂 B.充入CO C.充入H2 D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c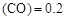 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v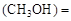 mol /(L·min),
mol /(L·min),
CO的转化率为 。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)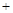 CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
C(s)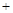 H2O(g)
H2O(g)  CO(g)
CO(g)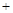 H2(g) 平衡常数K2
H2(g) 平衡常数K2
CO(g)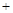 H2O(g)
H2O(g)  H2(g)
H2(g)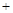 CO2(g) 平衡常数K3
CO2(g) 平衡常数K3
则K1、K2、K3之间的关系是: 。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液c;M、N是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若M、N都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:极(填“M”或“N”)附近先呈红色;电解饱和NaCl溶液的总反应方程式:。
(2)若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①N电极反应式是。(说明:杂质发生的电极反应不必写出)
②下列说法正确的是________。
| A.电能全部转化为化学能 |
| B.在电解精炼中,电解液中有Al3+、Zn2+产生 |
| C.溶液中Cu2+向阳极移动 |
| D.阳极泥中可回收Ag、Pt、Au等金属 |
(3)用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为16g,则阳极上产生的气体在标准状况下的体积为 L 。
在一定体积的密闭容器中,进行化学反应2CO2 (g)+N2 (g) 2CO (g)+2NO (g),其化学平衡常数K和温度t的关系如下表:
2CO (g)+2NO (g),其化学平衡常数K和温度t的关系如下表:
| t / ℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________________________。
(2)正反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________。
A.容器中压强不变B.混合气体中c (CO)不变
C.v正(N2)=v逆(NO)D.c(CO2)="c" (CO)
可逆反应:aA(g)+ bB(g)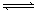 cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: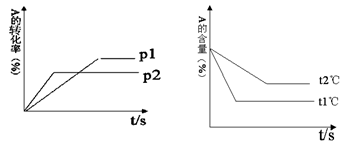
(1)压强P1比P2 (填大或小);
(2)(a+b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);
(4)正反应为(填吸热或放热)反应。
(2分)1.2g碳与适量的水蒸气反应生成CO和H2,需吸收13.128 kJ热量,此反应的热化学方程式是。
常温下,有下列7种溶液:A.Na2CO3B.CH3COONaC.AlCl3
D.CH3COOHE.NaHCO3F.NaOHG.HCl。
请回答有关问题:
(1)A溶液显碱性的离子方程式是:;
(2)将C溶液蒸干灼烧后得到的固体是(写化学式):;C与E是“泡沫灭火器”的药品,写出两溶液混合反应的离子方程式:;
(3)若A、E两种溶液的pH相同,物质的量浓度大小关系是。
(4)A、B、F溶液各25mL、物质的量浓度均为0.1mol/L,若分别加入25mL 0.1mol/L 的G溶液后,pH最大的是:。(填“A、B或F”)