密闭体系中发生下列反应:N2 + 3H2 ="===" 2NH3(正反应为放热反应),如图是某一时间段反应速率与反应进程的曲线关系图。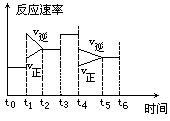
回答下列问题:
(1)处于平衡状态的时间段是_________________________________________________________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1:_______ t3:_______ t4:_________
(3)下列时间段中,氨的百分含量最高的是________
| A.t 0~t1、 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
A、B、C、D、E、F六种短周期元素,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为1s22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道数有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且离子半径A小于F。回答:
(1)上述六种元素中,哪种元素的原子的第一电离能最大?说明理由。
(2)比较C、D元素的第一电离能,并解释。
(3)将上述六种元素按电负性从小到大排列。
(4)C、D、E、F元素形成的最高价氧化物是离子化合物还是共价化合物?
美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方。下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
| 电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
| 电负性 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
0.8 |
请仔细分析,试回答下列问题:
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:_________________________________
同周期中,电负性与原子半径的关系为:___________________________________
(2)预测周期表中电负性最大的元素应为________(填元素符号);估计钙元素的电负性的取值范围:________<Ca<________。
(3)预测周期表中,电负性最小的元素位于第________周期________族(放射性元素除外),其基态原子核外电子排布式可表示为________________________。
已知X、Y、Z、T四种元素中,只有T不是短周期元素,与它们有关的部分信息如下表:
| 元素编号 |
元素性质或原子结构 |
| X |
其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高 |
| Y |
在地壳中的含量居于第三位,单质由电解法制取,其化学性质活泼,但在空气中能稳定存在;其离子半径在同周期中金属离子中最小 |
| Z |
原子核外有五种不同能量的电子,且最外层有2个未成对电子 |
| T |
其合金在生产和生活中用量最大,原子核外有4个电子层,在化学反应中可以失去最外层的2个电子和次外层的1个电子 |
(1)Y元素在周期表中的位置为___________________________________________,
写出X原子核外电子排布图:______________。
(2)冶炼T元素单质的主要反应中,还原剂是______,T元素的单质冶炼方法与Y元素的单质冶炼方法不同,其原因是_____________________________________________。
(3)对Z元素的单质或化合物描述一定正确的是________。
a.单质不溶于任何溶剂 b.其最高价氧化物的水化物为弱酸
c.其最高价氧化物常温下为气态 d.气态氢化物不稳定
(4)上述四种元素中,其最高价氧化物的水化物呈两性的物质是________(填化学式),试用方程式表示其两性的原因__________________________________________________
PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构
⑵请在以下空格内画出这两种固体分子的几何构型图,淡黄色固体:,黄绿色固体:
(3)淡黄色固体物质是由分子组成,黄绿色固体物质是由分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是
某些化学键的键能如下表所示(kJ·mol-1):
| 键 |
H-H |
Br-Br |
I-I |
Cl-Cl |
H-Cl |
H-I |
H-Br |
| 键能 |
436 |
193 |
151 |
247 |
431 |
299 |
356 |
(1)把1mol Cl2分解为气态原子时,需要(填“吸收”或“放出”)能量
(2)1mol H2在2mol Cl2中燃烧,放出的热量KJ。
(3)由表中所列化学键形成的单质分子中,最稳定的是,最不稳定的是,形成的化合物分子中,最稳定的是,最不稳定的是,
(4)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是________。
A.Cl2 > Br2 > I2 B.I2 > Br2 > Cl2
(5)预测1mol H2在足量F2中燃烧比在Cl2中放热。