美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方。下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
| 电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
| |
|
|
|
|
|
|
|
|
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
| 电负性 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
0.8 |
请仔细分析,试回答下列问题:
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:_________________________________
同周期中,电负性与原子半径的关系为:___________________________________
(2)预测周期表中电负性最大的元素应为________(填元素符号);估计钙元素的电负性的取值范围:________<Ca<________。
(3)预测周期表中,电负性最小的元素位于第________周期________族(放射性元素除外),其基态原子核外电子排布式可表示为________________________。
(16分)中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性。在 25 ℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在如下平衡H2O  H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
| A.向水中加入NaHSO4溶液 |
| B.向水中加入Cu(OH)2固体 |
| C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1] |
| D.在水中加入H2SO4溶液 |
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,若用pH计测定,则pH 7 (填“>”“<”或“=”),溶液呈 性(填“酸”“碱”或“中”)。
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g)ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
2NO(g)ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的ΔH>0,简述该设想能否实现的依据 。
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1) I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g) 2I2O5(s) ΔH="-75.56" kJ·mol-1
2I2O5(s) ΔH="-75.56" kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH="-566.0" kJ·mol-1
2CO2(g) ΔH="-566.0" kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2) 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①该反应的化学平衡常数表达式为K= 。
②一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 (填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. N2和CO2的体积比保持不变
d. 每生成1 mol N2的同时生成2 mol NO
③若在一定温度下,将2 mol NO、1 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如下图所示。若保持温度不变,20 min时再向容器中充入CO、N2各0.6 mol,平衡将 (填“向左”、“向右”或“不”)移动。20 min时,若改变反应条件,导致N2浓度发生如右图所示的变化,则改变的条件可能是 (填字母)。a. 加入催化剂 b. 降低温度 c. 增加CO2的量
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)  2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为 ;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“<”、“>”或“=”),简单说明原因 ;
(4)若其它条件不变,在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,在图中作出从t0→t1→t2点这段时间内SO2的物质的量变化曲线。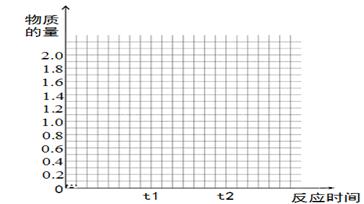
(10分)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式_____________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
若在A项所得溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为: 。
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图1中的 曲线表示(填序号)。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如下图2所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。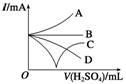
图1图2
(16分)“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。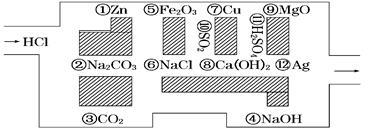
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________(填写物质序号)。
(3)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(4)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。