为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐, 其物质的量之比为1:1,写出离子方程式。
其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
| A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高 | |
| B.防止生成的盐分解 | C.催化剂在冷水中活性最强 |
| D.该反应是放热反应,为防止温度过高,采用降温 |
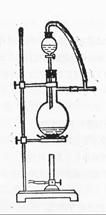
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么? 可以用图二代替吗?。
可以用图二代替吗?。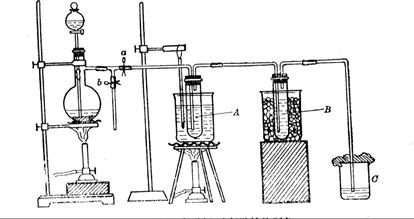
图一 图二
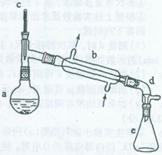
醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如下: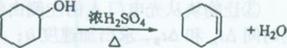
可能用到的有关数据如下:
| 相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
溶解性 |
|
| 环己醇 |
100 |
0.9618 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.8102 |
83 |
难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯l0 g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是_______________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__________。
(4)分液漏斗在使用前须清洗干净并__________;在本实验分离过程中,产物应该从分液漏斗的______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__________(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.玻璃棒 D.冷凝管
(7)本实验所得到的环已烯产率是__________(填正确答案标号)。
A.41% B.50% C.61% D.70%
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下:
(1)“较纯铜”转化为氧化铜时,应将其置于内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是。
a.灼烧过程中部分氧化铜被还原b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、、冷却结晶、、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① 。
②。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。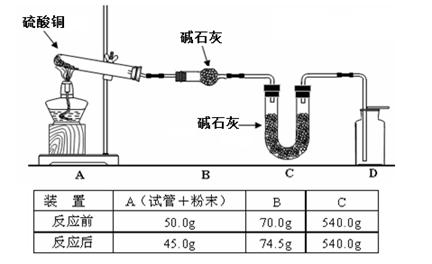
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、;B也必须添加温度控制装置,应该是(选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①;②;③洗涤;④干燥。
(4)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是。
ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
(5)判断滴定终点的现象。原ClO2溶液的浓度为g / L(用步骤中的字母代数式表示)。
根据要求完成下列实验。(a、b 为弹簧夹,其他装置略去)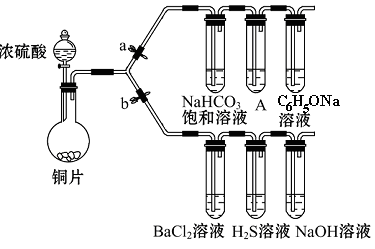
(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是_________________________________________,
装置A中的足量的试剂是 。
(2)连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:____________________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是_______________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:____________________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是__________________,_________________。
(6)写出其中SO2显示还原性并生成白色沉淀的总的离子方程式___________________________________________________________。
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。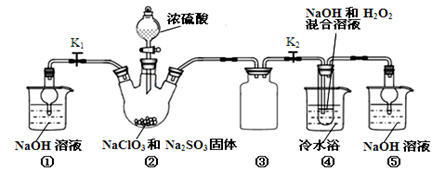
完成下列填空:
(1)装置②中产生ClO2的化学方程式为。装置③的作用是。
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②;③;④低于60℃干燥,得到成品。
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+ 4I-+4H+ →2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。配制待测液需用到的定量玻璃仪器是;
(4)取25.00mL待测液,用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为。
(5)通过分析说明装置①在本实验中的作用。