含苯酚的工业废水的方案如下图所示: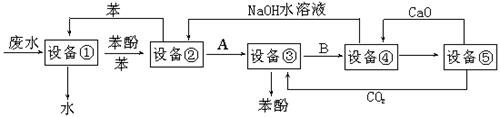
回答下列问题:
(1)设备①进行的是 操作(填写操作名称),实验室这一步操作所用的仪器是 。
(2)由设备②进入设备③的物质A是 。
(3)在设备③中发生反应的化学方程式为 。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、 和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、 。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是 。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
氮化铝(AlN)是一种新型无机非金属材料,其制取原理为:
Al2O3+3C+N2 2AlN+3CO。在制取氮化铝时由于反应不完全,产品中有氧化铝和碳。
2AlN+3CO。在制取氮化铝时由于反应不完全,产品中有氧化铝和碳。
为了分析某AlN样品的组成,某实验小组进行了如下探究。
【实验1】测定样品中氮元素的质量分数。
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).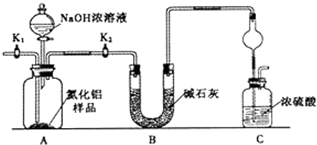
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(1)如图C装置中球形干燥管的作用是__________________________。
(2)完成以下实验步骤:组装好实验装置,首先___________,再加入实验药品.然后______,
打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,缓缓通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是__________。
(3)若去掉装置B,则导致测定结果____________(填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见_______________________。
【实验2】按以下步骤测定样品中铝元素的质量分数。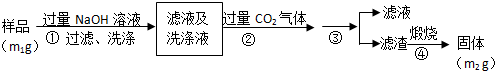
(4)步骤②生成沉淀的离子方程式为___________________。
(5)操作③需要的玻璃仪器有__________________________。
(6)A1元素的质量分数为________(用m1、m2表示)。
【实验3】测定样品中碳元素的质量分数。
称取10.00g样品置于反应器中,通往2.24LO2,在高温下充分反应后得到3.36L气体(AlN不跟O2反应),测得其密度为1.61g•L-1(体积及密度均已换算成标准状况)。
(7)计算该样品中碳元素的质量分数_____________。
过氧化氢的水溶液称为双氧水,常用作消毒剂、杀菌、漂白及工业生产原料等。
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用。
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是_______(填序号);
A.10mL量筒B.酸式滴定管C.碱式滴定管D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、_________(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:____MnO4-+___H2O2+___H+→___Mn2++___H2O+___;
②该小组一共进行了四次测定实验,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 消耗KMnO4溶液体积/mL |
25.00 |
25.02 |
20.00 |
24.98 |
根据所给数据,计算原过氧化氢溶液中H2O2质量分数____________________________。
(4)下列操作会导致测定结果偏高的是_____________。
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现__________性;
(6)若要验证H2O2不稳定性,操作是____________________________。
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件。
| 实验序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 双氧水(mL) |
0.5 |
0.4 |
0.6 |
0.5 |
|||
| pH |
11 |
11 |
11 |
10 |
|||
| 反应时间 |
3 |
3 |
3 |
3 |
(碱式氧化镍 (Ni00H)可用作镍氢电池的正极材料。以含镍(Ni2+ )废液为原料生产 Ni00H的一种工艺流程如下:
(1)加入Na2C03溶液时,证明Ni2+已经完全沉淀的实验方法是 ,过滤时需用到的玻璃仪器有烧杯、 。
(2)写出碳酸镍与稀硫酸反应的离子方程式 : 。
(3)硫酸镍溶液可用于制备合成氨的催化剂C0ni(1-n) Fe204。
如图表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是 。
(4)写出在空气中加热Ni(0H)2NK0H)制取Ni00H的化学方程式: 。
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。 某化学兴趣小组对氯及其化合物进行探究。
(1)漂白精广泛用于饮用水消毒、医院环境消毒、游泳池消毒。资料查阅:随漂白精溶液酸性的增强,溶液会变为黄绿色。出现该现象的原因为 (用离子方程式表示)。
(2)实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100 左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。
①仪器X的名称为 。
②制备三氯化铁的反应开始前,需排除装置中的空气,采取的方法是 。
③实验装置的连接顺序是a 。
(3)设计实验证明FeCL3的氧化性比I2强: 。
某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:
已知:l.0mol·L﹣1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 , 分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;猜想2:在酸性条件下SO2与NO3﹣反应;猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色。
【得出结论】:猜想1成立.其结论正确吗? (填“是”或“否”)。若不正确,理由是
(用离子方程式表示)。
(5)乙同学设计实验验证猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填序号)。
a.0.1mol/L稀硝酸 b.1.5mol/LFe(NO3)2溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合的溶液
d.3.0mol/LNaNO3和0.1mol/L硫酸等体积混合的溶液
(6)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程: 、 。